时间:2017-03-05 13:37:30
1、选择题 某周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数为
[? ]
A.只能是x+l
B.可能是x+8或x+18
C.可能是x+2
D.可能是x+l或x+11或x+25
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物
[? ]
A.透明陶瓷材料硒化锌
B.半导体材料砷化镓
C.吸氢材料镧镍合金
D.超导材料K3C60
参考答案:A
本题解析:
本题难度:简单
3、选择题 因周期表中过渡金属元素性质递变规律并不明显,可将其省略从而得到一张新的周期表.现有前三周期元素A、B、C,它们在该新周期表中的相对位置如图,下列说法正确的是( )
A.若A原子的最外层电子数比电子层数少1,则C的一种氧化物可以使品红溶液褪色
B.若A的单质能与无水乙醇反应,则B的氧化物一定为酸性氧化物
C.若A的氧化物为酸性氧化物,则B的最高价氧化物的水化物为强酸
D.若A的氧化物可以与强酸、强碱反应,则氢化物的熔沸点C比B高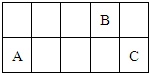
参考答案:根据元素在周期表中的位置知,A和C位于第三周期,B位于第二周期,
A.若A原子的最外层电子数比电子层数少1,则A为Mg元素,C为S元素,二氧化硫具有漂白性,能使品红溶液褪色,故A正确;
B.若A的单质能与无水乙醇反应,则A为Na元素,B为C元素,CO为不成盐氧化物,故B错误;
C.若A的氧化物为酸性氧化物,则A为Si元素,则B为F元素,F是非金属性最强的元素,没有最高价氧化物的水化物,故C错误;
D.若A的氧化物可以与强酸、强碱反应,则A是Al元素,C为Cl元素,B为O元素,水中含有氢键,氯化氢中不含氢键,氢键的存在导致水的沸点大于氯化氢,故D错误;
故选A.
本题解析:
本题难度:简单
4、选择题 某元素原子3p能级上有一个空轨道,则该元素为
A.Na
B.Mg
C.Al
D.Si
参考答案:D
本题解析:某元素原子3p能级上有一个空轨道,为3s23p2是硅
本题难度:简单
5、选择题 下列各组物质的性质依次递减的是( )
A.碱性:Al(OH)3、Mg(OH)2、NaOH
B.还原性:HI、HBr、HCl
C.酸性:HClO4、H2SO4、H3PO4
D.稳定性:H2CO3、NaHCO3、Na2CO3
参考答案:A.金属性:Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,
则碱性:NaOH>Mg(OH)2>Al(OH)3,故A正确;
B.非金属性:Cl>Br>I,元素的非金属性越强,对应的氢化物的还原性越弱,则还原性:HI>HBr>HCl,故B错误;
C.同周期元素从左到右元素的非金属性之间增强,则非金属性:Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H3PO4<H2SO4<HClO4,故C正确;
D.碳酸盐的稳定性大于碳酸氢盐,碳酸最不稳定,则稳定性:H2CO3、NaHCO3、Na2CO3依次递减,故D正确.
故选B.
本题解析:
本题难度:一般