时间:2017-03-05 13:29:55
1、选择题 现要除去NaCl中少量的CaCl2、Na2SO4杂质,下列选用试剂及其使用顺序正确的是(?)
A.Na2CO3、BaCl2
B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl
D.Ba(NO3)2、Na2CO3、HCl
2、选择题 下列能达到实验目的的是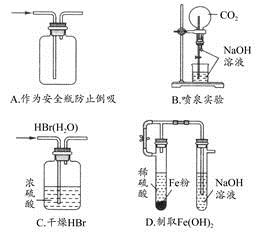
3、填空题 (12分)甲、乙两人分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为?
(2)甲:量取18 mol/L的浓硫酸?mL,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小 心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①实验所用的玻璃仪器除烧杯和容量瓶外,还有?、?、?;
②使用容量瓶前必须进行的一步操作是?
③ 定容的正确操作是?
(3)乙:用100 mL量筒量取20 mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100 mL 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中 错误之处?
错误之处?
4、实验题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下图所示装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 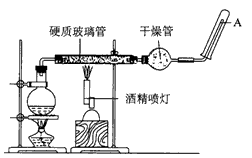
请回答该实验中的问题。
(1)该反应的反应方程式为 ____;该氧化还原反应的还原剂是____,氧化剂是____。
(2)实验前必须对整套装置进行气密性检查,操作方法是___。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是___ ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是____。
(4)酒精灯和酒精喷灯点燃的顺序是___ ,理由是____。
(5)干燥管中盛装的物质是___,作用是___。
(6)试管中收集到的气体是___,如果要在玻璃管A 处点燃该气体,则必须对该气体进行___,方法是 ____。这一操作的目的是___
5、简答题 髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料.实验室用硫铁矿烧渣(Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如图所示.请回答有关问题: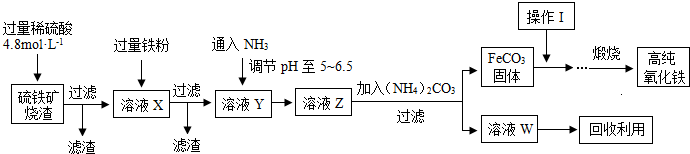
(1)过滤操作中的玻璃仪器为______.
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为______.
(3)溶液X发生反应的离子方程式为______.
(4)简述如何检验溶液Z中的阴离子______.
(5)操作I的名称是______.列举W的一种用途______.
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示)______.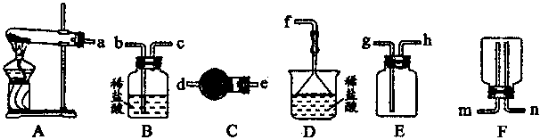
(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论______.