时间:2017-03-05 13:29:55
1、实验题 已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
(1)该反应的反应原理为以下化学方程式,试配平:
___KClO3+____H2C2O4?→____KHCO3+____ClO2↑
(2)B装置的作用是_________________________________。
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因?_________________?。
(4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究。
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:_____________________。
②基于假设2,设计实验方案,进行实验。请在下标中写出实验步骤以及预期现象和结论。限选实验试剂:1?mol/L?H2SO4、0.1?mol/L?HCl、0.01?mol/L?KMnO4、澄清石灰水。 
参考答案:(1)?2?1?2?2
(2)将ClO2冷凝收集
(3)过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3。(或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3)
(4)①只存在CaC2O4? ②
本题解析:
本题难度:一般
2、填空题 我国规定饮用水质量标准必须符合下列要求:
| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5 mol·L-1 |
| 细菌总数 | <100个/mL |
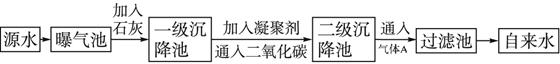
参考答案:(1)Ca2++HCO-3+OH-=CaCO3↓+H2O,Mg2++2OH-=Mg(OH)2↓?
(2)③? Fe(OH)3?(3)调节pH?除去Ca2+?
(4)杀菌消毒?强氧化?(5)①③?
本题解析:(1)源水中存在Ca2+,Mg2+,HCO-3,Cl-,溶质为Ca(HCO3)2,Mg(HCO3)2,CaCl2,MgCl2,分别与Ca(OH)2发生复分解反应,化学方程式为:?Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O;?Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O;?MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2?。根据以上三个反应可以写出离子方程式:?Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓。?
(2)常用明矾、FeCl3溶液作源水的凝聚剂,利用Al3+或Fe3+水解成Al(OH)3或Fe(OH)3胶体吸附水中悬浮的固体颗粒,这一过程既有化学变化又有物理变化,如果用FeSO4·7H2O作凝聚剂,Fe2+发生水解:Fe2++2H2O Fe(OH)2+2H+,Fe(OH)2又迅速被氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成Fe(OH)3沉淀。
Fe(OH)2+2H+,Fe(OH)2又迅速被氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成Fe(OH)3沉淀。
(3)通入CO2的目的是调节pH和进一步除去水中的Ca2+。?
(4)通入气体A用于对源水杀菌消毒,气体A必须有强氧化性。?
(5)代替A气体的物质必须有强氧化性,可选择Ca(ClO)2,K2FeO4,O3等。
点评:本题主工考查源水处理成自来水的工艺流程,难度不大,侧重考查学生实验分析能力和逻辑推断能力,解题的关键是要结合题干信息,分析每一流程的作用,从而准确作答。
本题难度:一般
3、实验题 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。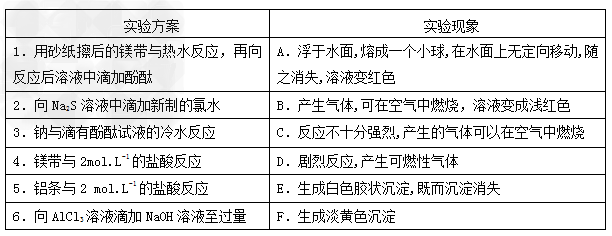
请你帮助该同学整理并完成实验报告﹕
(1 )实验目的:?;
(2 )实验用品:
仪器:①? __? ②?_ _? ③?___??④? ⑤镊子? ⑥小刀?⑦玻璃片? ⑧砂纸?⑨试管夹
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、Na2S 溶液、 AlCl3溶液、NaOH 溶液等。
(3 )实验内容:(填写与实验方案相对应的实验现象)
1? ? ? 2? ? 3? ? ? 4? ? ? 5? ? ? 6? ? ?(用A—F表示);
写出③的离子方程式? ? ;
(4)实验结论:? ? ;
参考答案:(1)探究同周期元素的金属性和非金属性的递变规律。?
(2)胶头滴管;烧杯;试管;酒精灯?
(3)1﹕B;?2﹕F;3﹕A;4﹕D;5﹕C;6﹕E?
? 2Na+2H2O=2Na++2OH-+H2↑?
(4)金属性:Na > Mg > Al?;非金属性:Cl > S
本题解析:
本题难度:一般
4、实验题 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图所示。 加热聚丙烯废塑料得到的产物如下表所示: 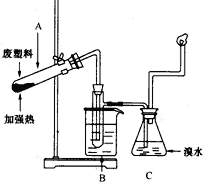 ?
? 
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。 A中残留物聚乙炔写出反应②、③的化学方程式_____________;____________ 。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有__________ 种。
(3)锥形瓶C中观察到的现象是____________ ,经溴水充分吸收后,剩余气体经干燥后平均相对分子质量为________________ 。
(4)写出C中逸出的气体在工业上的两种用途___________ 、___________。
参考答案:
(1)CaC2+2H2O→Ca(OH)2+C2H2 ;CH≡CH→
(2)4
(3)棕黄色溶液变无色(或溴水褪色);4.8
(4)合成氨原料; 作燃料或有机化工原料
本题解析:
本题难度:一般
5、选择题 如图所示装置进行实验(图中铁架台等仪器均已略去).在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,II中有气泡冒出;一段时间后关闭止水夹,II?中液面上升,溶液由无色变为浑浊.符合以上实验现象的I和II中应加入的试剂是( )
| A | B | C | D I CaCO3 稀盐酸 Na2CO3 稀硫酸 Zn 稀盐酸 Cu 稀硫酸 II Ca(OH)2 NaOH AgNO3 Ba(OH)2 |
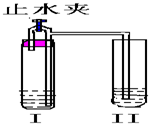
参考答案:A.打开止水夹时,I中碳酸钙和盐酸反应会生成气体二氧化碳,Ⅱ中会看到气泡,但是关闭止水夹后,被压入的稀盐酸和氢氧化钙反应生成可溶性的氯化钙,看不到浑浊,所以不符合实验现象,故A错误;
B.打开止水夹时,I中碳酸钠和稀硫酸反应生成气体二氧化碳,Ⅱ中会看到气泡,但是关闭止水夹后,被压入的稀硫酸和氢氧化钠溶液反应生成可溶性的硫酸钠,看不到浑浊,所以不符合实验现象,故B错误;
C.打开止水夹时,I中锌和稀盐酸反应生成氢气,Ⅱ中会看到气泡,但是关闭止水夹后,被压入的稀盐酸和硝酸银溶液反应生成氯化银白色沉淀,看到浑浊现象,符合实验现象,故C正确;
D.打开止水夹时,I中铜和稀硫酸不会反应,Ⅱ中不会看到气泡,同时关闭止水夹后也不会有液体被压入Ⅱ中,溶液也不会变浑浊,不符合实验现象,故D错误;
故选C.
本题解析:
本题难度:一般