时间:2017-03-05 13:29:55
1、选择题 下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 A 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 溶解度:S(CaCO3)<S(CaSO4) B 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 该电极为阳极 C 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 氧化性:Cu2+>Fe3+ D 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 该溶液中一定含有Ag+ |
参考答案:A、硫酸钙和碳酸钙阴离子和阳离子比相同,可以直接比较溶解度和溶度积常数,处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解,发生了沉淀转化,故A正确;
B、用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成,依据电解原理分析,阴极是氢离子得到电子生成氢气,电极附近氢氧根离子浓度增大,和镁离子生成沉淀,故B错误;
C、向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出说明有生成,Cu2+>Fe2+;不能证明铜离子和三价铁离子氧化性的强弱,故C错误;
D、向某溶液中先滴加硝酸酸化,硝酸具有强氧化性,溶液中若是亚硫酸根离子,被硝酸氧化为硫酸根离子,再滴加BaCl2溶液,有白色沉淀生成,溶液中不一定含有银离子,故D错误;
故选A.
本题解析:
本题难度:简单
2、实验题 ⑴某实验小组为确认H2CO3、CH3COOH和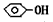 的酸性强弱,设计了下图装置,一次实验即可达到目的,请依据此实验填空:
的酸性强弱,设计了下图装置,一次实验即可达到目的,请依据此实验填空:
①锥形瓶内装某可溶性正盐固体,分液漏斗中所盛试剂的名称是___________。
②装置F中所盛的试剂是__________,其作用是___________。
③装置G中发生反应的化学方程式是____________________。 
⑵下图装置可用于收集气体X并验证其某些化学性质,你认为正确的是__________________。 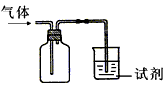

参考答案:⑴①醋酸溶液;②饱和NaHCO3溶液;除去CO2中的CH3COOH杂质;③C6H5ONa+CO2+H2O→NaHCO3
+C6H5OH
⑵C
本题解析:
本题难度:一般
3、实验题 (8分)
(1) 体积相同,pH相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率_____________,充分反应后,产生氢气的量_____________(相同、盐酸的多、醋酸的多)
(2) 在一定量的盐酸溶液中加入足量的锌粒,若使产生氢气的量保持不变,但反应速率加快,可加入__________晶体,要使产生氢气的量不变,但反应速率减慢,可加入____________晶体。
可选择的晶体有:
A.纯碱
B.烧碱
C.胆矾
D.醋酸钠 (E) KHSO4
(3)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。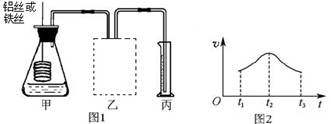
在虚线框内连接合适的装置___________________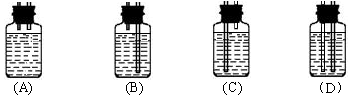 ?
?
②若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量____________________________________。
③实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
参考答案:(8分)
(1)一样,醋酸多
(2)C;D?
(3)①B?②产生相同体积的气体所需时间 ③反应放热,溶液温度升高
本题解析:考查弱电解质的电离、条件对反应速率的影响
(1)pH相同的盐酸和醋酸溶液中c(H+)相同,故与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率相同;
随着H+不断的被消耗,由于弱酸可电离出H+,故最终醋酸中得到的氢气多
(2)氢气的量由H+的量决定,而反应速率与外界条件有关;
故使产生氢气的量保持不变,但反应速率加快,可向溶液中加入胆矾,置换出的铜与锌形成原电池,加快产生氢气的速率,但H+的总量不变,氢气的总量也不会改变;
要使产生氢气的量不变,但反应速率减慢,可加入醋酸钠,由于CH3COO-可与溶液中的H+结合:CH3COO-+H+ CH3COOH,H+浓度减小,反应速率减慢,但随其总量并不减小
CH3COOH,H+浓度减小,反应速率减慢,但随其总量并不减小
(3)①通过排水法来测定气体的体积,需要短管进,长管出,故选择B装置
②由反应速率的概念可知,它的大小决定与单位时间内反应物或产物浓度的改变值,故还可通过测量产生相同体积的气体所需时间来判定快慢
③在本实验中,反应速率与温度与浓度有关,开始阶段,反应放热,加快了反应速率,但随着反应的进行,氢离子浓度逐渐减小,反应结束阶段,反应又逐渐减小。
本题难度:简单
4、实验题 铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。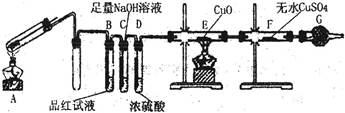
(1)证明反应所产生的气体中有SO2生成的现象是?。
(2)证明气体中含有氢气的实验现象是?。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
| 实验操作 | 预期现象 | 结论 |
| 取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入? ?。 | ? ? | ? ? |
| 步骤②:往b试管中滴入? ?。 | ? ? | 溶液含有Fe3+ |
参考答案:(16分)(1)品红试液变浅(或褪色)?(2分)
(2)E中黑色(CuO)变成红色,F中白色粉末(CuSO4)变成蓝色;(2分)
(3)假设3:溶液中铁元素只有Fe2+?(2分)
【实验探究】
实验操作
预期现象
结论
取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入少量(1分)0.01mol/L酸性KMnO4溶液(1分)。
KMnO4溶液的紫红色褪去(或变浅)(2分)
?溶液含有Fe2+(2分)
步骤②:往b试管中滴入几滴(1分)KSCN溶液,充分振荡(1分)[或几滴(或少量)0.1mol/LKI溶液和淀粉溶液(1分)] 。
溶液变为血红色(2分)
[或溶液变为蓝色(2分)]
溶液含有Fe3+
本题解析:(1)SO2具有漂白性、酸性、还原性和氧化性,读图可知,该实验用品红溶液检验是否有SO2生成,若品红溶液褪色或变浅,说明装置A中反应产生的气体含有SO2;(2)氢气具有强还原性,在加热条件下能使黑色的氧化铜还原为红色的单质铜,H2被氧化为能使白色的无水CuSO4固体变蓝的H2O,若装置E中黑色固体变为红色,F中白色粉末变为蓝色,说明装置A中放出的气体中含有H2;(3)常温下铁被浓硫酸钝化,表面有一层致密氧化物薄膜,加热下强氧化性、强酸性的浓硫酸可以将铁氧化为铁盐,而过量的单质铁可以将铁盐还原为亚铁盐,因此反应后A的溶液中铁元素可能既有Fe2+又有Fe3+,也可能只有Fe3+,还可能只有Fe2+,根据已知假设1、假设2的信息推断假设3为溶液中铁元素只有Fe2+;根据铁及其化合物的性质可知,Fe2+具有还原性,能使酸性KMnO4溶液褪色,Fe3+具有氧化性,能将KI溶液还原为能使淀粉溶液变蓝的I2,Fe2+遇KSCN溶液不变红,而Fe3+遇KSCN溶液变红,大量含有Fe3+的溶液呈黄色,与溴水的颜色相同,由此可以选择适当的试剂设计实验方案验证A的溶液中既有Fe2+又有Fe3+。
本题难度:一般
5、实验题 工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如下图: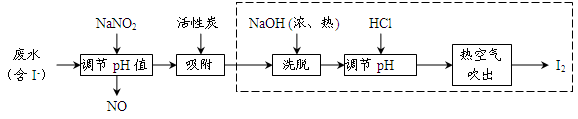
(1)向废水中加入NaNO2并调节pH<4,写出反应的离子方程式__________________。
(2)用活性炭吸附生成的单质碘的目的是__________________________,用浓、热NaOH洗脱吸附的碘的化学方程式为___________________________________。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是___________;若取少量该溶液在实验室中分离得到单质碘,需要进行的操作为__________________。
(4)流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,写出反应的化学方程式:________________________________。
(5)工业上虚框内流程还可用如图操作代替,评价下图流程的优点___________________________(写出一条)。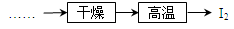
参考答案:(1)2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O (2分)
(2)富集单质碘(1分)? 3I2 + 6NaOH → NaIO3+ 5NaI+ 3H2O(2分)
(3)单质碘在水中溶解度小,易升华(1分)?萃取?分液?蒸馏(3分)
(4)4NaOH+ O2+ 4NO → 4NaNO2+ 2H2O(2分)
(5)减少了化学药品的投入量,使成本大大降低。(或生产环节减少;或药品对设备无腐蚀性等)(1分,合理即可)
本题解析:(1)根据流程图信加入NaNO2时有NO生成,发生了氧化还原反应,故其离子方程式2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O。
(2)用活性炭吸附生成的单质碘的目的是富集单质碘。根据流程图最后加入酸时又有碘生成,可知用浓、热NaOH洗脱吸附的碘的化学方程式为3I2 + 6NaOH → NaIO3+ 5NaI+ 3H2O。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是单质碘在水中溶解度小,易升华;若取少量该溶液在实验室中分离得到单质碘先后进行的操作为 萃取、分液、蒸馏。
(4)根据氧化还原反应原理,反应的化学方程式4NaOH+ O2+ 4NO → 4NaNO2+ 2H2O。
(5)从能源的利用和环保方面思考做答,可以是减少了化学药品的投入量,使成本大大降低。(或生产环节减少;或药品对设备无腐蚀性等)
本题难度:一般