时间:2017-03-05 13:25:19
1、判断题 标明下列装置中电解池的阴极和阳极,试写出电极反应式,并判断是氧化反应还是还原反应。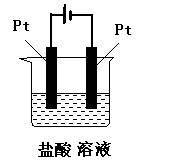
参考答案:与电源正极相连的一极是电解池的阳极,反应式为:2Cl-→Cl2↑+2e-(氧化反应);
与电源负极相连的一极是电解池的阴极,反应式为:2H++ 2e-= H2↑(还原反应)。
本题解析:在电解池中,与电源正极相连、发生的电极反应
是氧化反应的电极是阳极,与电源负极相连、发生的电极
反应是还原反应的电极是阴极。依据这个原则即可标明电
解池的阴极和阳极,试写出电极反应式,并判断是氧化反
应还是还原反应。
本题难度:一般
2、选择题 用电解法提取氯化铜废液中的铜,方案正确的是
[? ]
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列叙述不正确的是?
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.将地下钢管与直流电源的正极相连,用来保护钢管
C.电解饱和食盐水制氢氧化钠,可以用铁做阴极
D.氢氧燃料电池中,氢气在负极发生氧化反应
参考答案:B
本题解析:A、金属腐蚀的本质是金属失电子,发生氧化反应,正确;B、钢管与电源正极相连,即钢管作阳极,易失电子,被氧化,不能起到保护钢管的作用,错误;C、电解时金属作阴极是可以的,因为阴极得电子,发生还原反应,金属单质不会得电子,正确;D、氢氧燃料电池负极发生氧化反应,失电子,化合价升高,所以氢元素的化合价升高,氢气被氧化,正确,答案选B。
本题难度:一般
4、选择题 下列有关阿伏加德罗常数说法正确的组合是
①标准状况下,22.4L氯气与足量的热NaOH溶液反应,转移电子数目为NA
②25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH-数目为0.2 NA
③电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子数不一定等于2NA
④标准状况下,33.6L氟化氢含有氟原子的数目为1.5NA
⑤2.24LCO2和2.8gN2组成的混合物中质子数为2.8 NA
⑥14gN60(分子空间结构类似C60)中含有的N—N键数目为1.5 NA
A.③⑥
B.①③⑥
C.①③④⑥
D.①②⑤⑥
参考答案:A
本题解析:①标准状况下,22.4L氯气物质的量为1mol,氯气与足量的热NaOH溶液反应为:Cl2+6NaOH=NaClO3+5NaCl+,可知电子转移的对应关系为:Cl2~5e?,则转移电子数目为5NA,错误;②25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH-物质的量为1.0L×0.1mol?L?1=0.1mol,则OH-数目为0.1 NA,错误;③电解精炼铜时,阳极上Cu,少量Zn、Fe发生失电子反应,所以阳极质量减少64g,则转移到阴极的电子数不一定等于2NA,正确;④因为氟化氢的沸点是19.54℃,在标准状况下是液体,不能用22.4L/mol换算,错误;⑤没有指明是否为标准状况,无法求算2.24L CO2物质的量,错误;⑥每个N原子与其它N原子形成3个N—N,根据均摊法,每个N原子均摊1.5个N—N键,14gN60N原子物质的量为1mol,则含有的N—N键数目为1.5 NA,正确,故答案为A。
考点:本题考查阿伏加德罗常数的计算。
本题难度:一般
5、选择题 若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上?
②将银片接在电源的正极上?
③在铜片上发生的反应是:Ag++e-→Ag?
④在银片上发生的反应是:4OH--4e-→O2↑+2H2O
⑤需用硫酸铜溶液为电镀液 ?
⑥需用硝酸银溶液为电镀液.
A.①③⑥
B.②③⑥
C.①④⑤
D.②③④⑥
参考答案:阳极电镀原理,若在铜片上镀银时,铜做电解池的阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银做电解池的阳极和电源正极相连,铜失电子发生氧化反应生成铜离子;电解质溶液为硝酸银溶液;
①将铜片应接在电源的负极上,故①错误;
②将银片应接在电源的正极上,故②正确;
③在铜片上发生的反应是:2Ag++2e-→2Ag?故③正确;
④在银片上发生的反应是:2Ag++2e-→2Ag,故④错误;
⑤用硫酸铜溶液为电镀液,阴极析出铜,故⑤错误;
⑥需用硝酸银溶液为电镀液.故⑥正确;
故选B.
本题解析:
本题难度:简单