时间:2017-03-03 01:04:46
1、填空题 (8分)20℃时,醋酸的电离平衡常数为1.6×10-5。
(1)试计算20℃时0.01mol?L-1的醋酸溶液中氢离子浓度。
(2)室温时,向0.2mol?L-1的醋酸溶液中加入等体积的0.1mol?L-1的NaOH(aq),充分反应后所得溶液的PH=4,则:
①所得溶液中各离子(包括CH3COOH分子)浓度大小关系是:______________________,
②所得溶液中的物料守恒式为:________+________=__________=_________mol?L-1。
③c(CH3COOH)=_____________mol?L-1(写出算式,不做近似计算)
参考答案:(8分)(1)4×10-4mol?L-1
(2)①c(CH3COO-) >c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
②c(CH3COO-)+c(CH3COOH)=2c(Na+)=0.1mol?L-1
③c(CH3COOH)=0.05-10-4+10-10mol?L-1(各2分)
本题解析:略
本题难度:一般
2、选择题 水的电离平衡为H2O 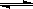 H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中滴入稀醋酸,c(H+)增大
D.向水中加入少量固体NaClO,平衡逆向移动
参考答案:D
本题解析:因为水溶液电离平衡反应△H>0为吸热反应,A、将水加热后电离反应吸收热量,使反应正向进行,故A正确;B、Kw只与温度有关,与溶液浓度无关,因为表示反应在恒温下进行,故B正确;C、在水溶液中滴入醋酸后醋酸发生电离反应CH3COOH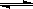 H++CH3COO-,c(H+)浓度增大,故C正确;D、 NaClO溶解放热,电离反应应正向移动,故D错误。
H++CH3COO-,c(H+)浓度增大,故C正确;D、 NaClO溶解放热,电离反应应正向移动,故D错误。
本题难度:一般
3、选择题 有等体积、等pH的Ca(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
[? ]
A.V3>V2>V1
B.V3=V2=V1
C.V3>V2=V1
D.V1=V2>V3
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列图示与对应的叙述相符的是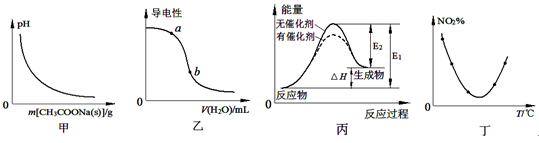
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
参考答案:D
本题解析:A、向醋酸溶液中加入醋酸钠固体后,则溶液中的醋酸根离子浓度增大,醋酸的电离平衡逆向移动,则溶液的氢离子浓度减小,pH增大,错误;B、向醋酸溶液中加水稀释,则溶液中的离子浓度减小,导电能力减弱,所以a点的氢离子浓度大于b点,则CH3COOH溶液的pH:a<b,错误;C、催化剂只能改变反应的活化能,不能改变反应热,错误;D、根据丁图可知,曲线的最低点为开始达到平衡时二氧化氮的含量,再升高温度,则二氧化氮的含量增大,说明升高温度,平衡逆向移动,则正反应是放热反应,△H<0,正确,答案选D。
考点:考查对图像的分析,化学平衡移动的判断
本题难度:一般
5、选择题 将体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别加水稀释m和n倍,溶液的PH都变成9,则m和n的关系是(?)
A.m>n
B.m="n"
C.m<n
D.无法确定
参考答案:A
本题解析:略
本题难度:简单