时间:2017-03-03 00:42:49
1、选择题 等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比
A.前者多
B.后者多
C.一样多
D.无法判断
参考答案:B
本题解析:正确答案:B
NaF是强碱弱酸盐,F++H2O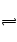 HF+OH― ,促进水电离。后者生成的OH―多,阴阳离子总数相比后者多。
HF+OH― ,促进水电离。后者生成的OH―多,阴阳离子总数相比后者多。
本题难度:困难
2、填空题 (16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
参考答案:(16分,每空2分)
I.(1)硫酸 (或者H2SO4)
(2)a d
(3)①在常压下,此反应的转化率已经达到96%,没有必要再增大压强了。
②-396.00 kJ/mo1
Ⅱ.(1)① 4.00×10-4
②
(2)① < ② 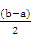
本题解析:I.(1)二氧化硫的催化氧化是工业生产硫酸的重要步骤;
(2)a、每生成1mol SO3的同时生成0.5mol O2,代表正逆两个反应方向且符合化学方程式中的系数比,符合正逆反应速率相等,达到平衡状态,正确;b、恒容条件下,气体的质量不变,所以气体的密度一直不变,不能判断是否达平衡状态,错误;c、体系中各物质的物质的量之比等于化学计量数之比时不一定达平衡状态,错误;d、该反应的特点是反应前后的气体的物质的量发生改变,所以恒容时气体的压强在变,达平衡时,气体压强不再变化,正确,答案选ac。
(3)①常压下,平衡时二氧化硫的转化率是96%,已经很高,所以没有必要再增大压强了;
②二氧化硫转化96%放出190.08KJ的热量,所以1mol二氧化硫气体完全反应则放出190.08kJ÷96%=198.00kJ的热量,所以该反应的热化学方程式中二氧化硫的系数是2,代表2mol的二氧化硫完全反应,放出的热量是198.00kJ×2=396.00kJ,所以△H=-396.00 kJ/mo1;
II.(1)①根据题意可知氨水的浓度是1mol/L, c(NH4+)= c(OH-)=0.02mol/L,所以氨水的电离常数K= c(NH4+)· c(OH-)/c(NH3·H2O)= 0.022mol/L/1mol/L= 4.00×10-4
②氨水稀释会促进一水合氨的电离,体积变为原来的2倍,则氢氧根离子浓度减小为原来的一半,根据勒夏特列原理,最终氢氧根离子、铵根离子的浓度仍会减小,所以图像的起点在0.01处,最大值在原图像的下方,如图 ;
;
(2)①若a=b,则二者恰好完全反应,溶液呈酸性,现在溶液呈中性,说明氨水过量,所以a<b;
②设二者的体积均是1L,因为b>a,则剩余氨水的物质的量是b-a,体积扩大到原来的2倍,所以剩余氨水浓度:c(NH3·H2O)=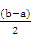 。
。
考点:考查化学平衡状态的判断,转化率的计算,热效应的计算,弱电解质的电离平衡的应用
本题难度:一般
3、选择题 下列表示物质变化的化学用语正确的是
[? ]
 2H++CO32-
2H++CO32- Fe(OH)3+3H+
Fe(OH)3+3H+ H3O++S2-
H3O++S2- Al(OH)3+3H2S
Al(OH)3+3H2S 参考答案:B
本题解析:
本题难度:简单
4、填空题 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074 nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1 |
参考答案:
本题解析:
本题难度:困难
5、选择题 某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
A.溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性
C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:D
本题解析:A、若溶液中NaOH过量,且碱性较强,则可存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),正确;B、溶液中离子间满足:c(CH3COO-)=c(Na+),由电荷守恒可知,c(H+)=c(OH-),溶液为中性,正确;C、若溶液中溶质仅为CH3COONa ,则水解显碱性,应存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),正确;D、若CH3COOH 较多,溶液可能呈酸性,可能满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),错误;选D。
考点:考查离子浓度的大小比较以及弱电解质的电离等知识。
本题难度:困难