时间:2017-03-03 00:23:27
1、选择题 设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA
B.78g过氧化钠中含阴离子数为2 NA
C.C2H4和N2组成的42g混合气体中原子的个数为3 NA
D.5NH4 NO3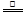 2HNO3+4N2↑+ 9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+ 9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
参考答案:D
本题解析:A.铁与稀硫酸反应生成亚铁离子,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.2NA,错误;B.过氧化钠中有一个阴离子,78g过氧化钠中含阴离子数为NA,错误;C. C2H4和N2的分子量均是28,但组成分子的原子数不相同,原子数无法确定,错误;选D。
考点:考查阿伏伽德罗常数及计算。
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数,下列说法正确的是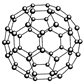
A.标准状况下1molHCl与HF的混合物的体积约为22.4L
B.N60结构如右图,28gN60单质中含有的N-N键个数为NA
C.1.72g生石膏(CaSO4·2H2O) 转化为熟石膏(2CaSO4·H2O) 失
去的结晶水数目为0.015NA
D.9 g重水所含有的电子数为5NA
参考答案:C
本题解析:阿伏加德罗常数正误判断题在注重对有关计算关系考查的同时,又隐含对某些概念理解的考查。试题计算虽然难度不大,但概念性强,区分度大,是每年高考的必考试题。选项A中,由于HF分子中存在氢键,在标准状况下呈液态,因此1molHCl与HF的混合物的体积应小于22.4L。选项B中,N60分子中所含N-N键的数目为60×3/2=90,因此28gN60单质中含有的N-N键个数为28×90/(14×60)=3NA。选项C中生石膏转化为熟石膏的化学方程式为:2[CaSO4·2H2O]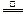 2CaSO4·H2O+3H2O,因此共失水0.015NA。9g重水的物质的量为
2CaSO4·H2O+3H2O,因此共失水0.015NA。9g重水的物质的量为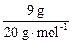 ="0.45" mol,其含有电子数为4.5NA。本题应选C。
="0.45" mol,其含有电子数为4.5NA。本题应选C。
本题难度:一般
3、计算题 (8分)32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.请回答:(不要求写计算过程)
(1)写出铜与稀硝酸反应的化学方程式
(2)NO为 mol.标准状况V(NO):V(NO2)=
(3)原硝酸溶液的浓度为 mol?L-1
(4)试描述实验过程中试管内产生气体现象
参考答案:(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)0.25,1:1; (3)10; (4)气体颜色逐渐变浅.
本题解析:(1)写出铜与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)设NO2的物质的量为x,NO的物质的量为y,则有
x+y=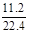
x+3y=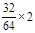
解得:x=0.25mol y=0.25mol
则V(NO):V(NO2)=1:1
(3)铜与硝酸恰好反应,根据N原子守恒,n(HNO3)=n(NO3-)+n(气体),又知n(Cu2+)=0.5mol,所以n(NO3-)=1mol,则n(HNO3)=1.5mol,c(HNO3)=" 10" mol?L-1。
(4)随着硝酸变稀,产生的NO2变少,NO变多,所以实验过程中试管内产生气体的现象是气体颜色逐渐变浅。
考点:计算题
点评:原子守恒解本题比较简单。
本题难度:困难
4、实验题 实验室用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸。
(1)所需仪器除了玻璃棒、烧杯、胶头滴管、量筒外,还需要哪个仪器才能完成该实验,请写出:?。
(2)计算所需浓硫酸的体积为________ mL 。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用___________。(填序号)
(3)实验中两次用到玻璃棒,其作用分别是:___________、__________。
(4)下列对容量瓶及其使用方法的描述中正确的是_____。
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线
1~2 cm处,改用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有_______。(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中。
③转移前,容量瓶中含有少量蒸馏水。
④定容时,仰视刻度线。
参考答案:(1)500mL容量瓶(2)5.4? ①(3)搅拌?引流(4)D(5)①④
本题解析:(1)配制一定物质的量浓度溶液需要仪器:一定规格容量瓶、胶头滴管、量筒、烧杯、玻璃棒、(天平)。(2)设浓硫酸体积为VmL,18.4×V×10-3=500×0.2×10-3,V=5.4mL。选择10mL量筒。(3)溶解时用玻璃棒搅拌、转移时用玻璃棒引流。(4)容量瓶上没有浓度;容量瓶不必烘干;不能直接在容量瓶中配制溶液;容量瓶使用前要查漏。(5)未洗涤烧杯和玻璃棒,n偏小,c偏小;未等稀释后的硫酸溶液冷却至室温V偏小,c偏大;容量瓶中有少量蒸馏水,c无影响;定容时仰视刻度线,V偏大、c偏小。
点评:填写容量瓶时一定要有规格;分析误差时根据c=n/V分析。浓硫酸溶于水放热,溶解后不能立即将溶液转移入容量瓶。
本题难度:简单
5、填空题 现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol。则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数为______个。
(3)该气体在标准状况下的体积为______L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为______。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______mol/L
参考答案: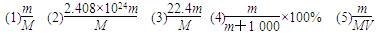
本题解析:略
本题难度:一般