时间:2017-03-03 00:23:27
1、选择题 配制250 mL 0.10 mol·L-1的盐酸溶液时,下列实验操作使所配溶液浓度偏大的是(? )
A.用量筒量取所需浓盐酸时俯视刻度
B.定容时仰视达标线
C.用量筒量取所需浓盐酸时倒入烧杯后,用水洗量筒2—3次,洗液倒入烧杯中
D.定容后倒转容量瓶几次,发现凹液面低于标线,再补几滴水达标线
参考答案:AB
本题解析:俯视量筒量取液体体积比读数偏多。
本题难度:简单
2、选择题 下列叙述中,正确的是
A.二氧化硫的摩尔质量是64g
B.一个镁的原子质量就是镁的相对原子质量
C.水的相对分子质量等于18g
D.一个16O的实际质量约等于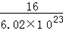 g
g
参考答案:D
本题解析:A、摩尔质量的单位是g/mol,错误;B、镁的相对原子质量是一个镁的原子质量与一个C-12原子质量的1/12的比值,错误;C、相对分子质量的单位不是g,错误;D、6.02×1023个O-16原子的质量大约是16g,所以一个16O的实际质量约等于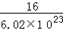 g,正确,答案选D。
g,正确,答案选D。
考点:考查对摩尔质量、相对原子质量的理解
本题难度:一般
3、选择题 若某氖原子的质量是a g,12C的原子质量是b g,Na表示阿伏加德罗常数的值。下列说法错误的是(? )
A.该氖原子的摩尔质量为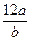 g
g
B.该氖原子的摩尔质量为aNa g·mol-1
C.w g该氖原子的物质的量为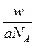 mol
mol
D.w g该氖原子所含的电子数是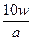
参考答案:A
本题解析:摩尔质量的单位为g·mol-1,A项错误;由摩尔质量的定义,摩尔质量与物质相对原子质量的关系及物质的量与物质质量、物质粒子数之间的关系可推知B、C、D项均正确。
本题难度:简单
4、选择题 下列说法正确的是( )
A.把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度改变为1.5 mol·L-1
B.把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
C.把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D.把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
参考答案:C
本题解析:A项,等体积混合后,溶液体积不一定是200 mL,硫酸的物质的量浓度不一定为1.5 mol·L-1;B项,3 mol·L-1的BaCl2溶液中c(Cl-)=6 mol·L-1,混合后,溶液中的c(Cl-)不是3 mol·L-1;D项,把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数大于10%。
本题难度:一般
5、选择题 下列说法一定正确的是
A.0.5 mol Cl2所占体积约为11.2 L
B.16 g O2中含有的分子数约为6.02×1023
C.0.1 mol/L NaCl溶液中含溶质的物质的量为0.1 mol
D.标准状况下,11.2 L N2和CO的混合气体所含原子数约为6.02×1023
参考答案:D
本题解析:
试题分析:A为指明所处的条件为标准状况,故气体的摩尔体积不一定为22.4L/mol,A错误;16g氧气的物质的量为16g/32g/mol=0.5mol,分子数为3.01×1023,,B错误;C未指明溶液的体积,C错误;11.2 L 气体的物质的量为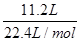 =0.5mol,二者均为双原子分子,所含原子数为0.5molx2x6.02×1023mol-1,D正确,答案选D.
=0.5mol,二者均为双原子分子,所含原子数为0.5molx2x6.02×1023mol-1,D正确,答案选D.
考点:气体的摩尔体积
本题难度:一般