时间:2017-03-02 23:49:12
1、选择题 欲迅速除去水壶底的水垢,又不损坏铝壶,最好选用( )
A.浓盐酸
B.稀硝酸
C.冷的浓硫酸
D.冷的浓硝酸
参考答案:A、浓盐酸可以溶解CaCO3和Mg(OH)2,能与铝反应,损坏铝壶,故A错误;
B、稀硝酸可以溶解CaCO3和Mg(OH)2,能与铝反应,损坏铝壶,故B错误;
C、铝在冷的浓硫酸中发生钝化,但硫酸钙微溶,生成的硫酸钙为附着在水垢上,阻止反应继续进行,故C错误;
D、冷的浓硝酸与CaCO3和Mg(OH)2反应,生成可溶的硝酸钙、硝酸镁,除去水垢,且铝在冷的浓硝酸中发生钝化,不损坏铝壶,故D正确;
故选D.
本题解析:
本题难度:一般
2、填空题 从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下: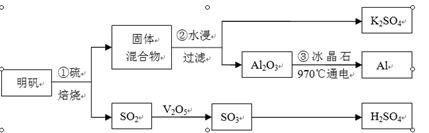
明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是?。
(2)步骤②中,为提高浸出率,可采取的措施有?。
A.粉碎固体混合物
B.降低温度
C.不断搅拌
D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是?。
(4)步骤③电解的化学方程式是?,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:?。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是?。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为?吨(列出计算表达式)。
参考答案:(1)KAl(SO4)2·12H2O(2分)
(2) AC (2分,多选、错选0分)
(3)蒸发结晶(2分,“蒸发浓缩、冷却结晶”给1分)
(4)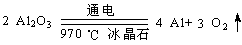 (2分)
(2分)
阳极中碳被氧化成CO2(CO)?(2分,用化学方程式表示也可,如:
C+O2 CO2或2C+O2
CO2或2C+O2 2CO?,条件用加热或970℃也可)
2CO?,条件用加热或970℃也可)
(5)NiO(OH)+H2O+e-=Ni(OH)2+OH-(2分)
(6)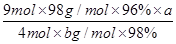 或
或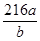 (3分,不带单位不扣分,化简也可以)
(3分,不带单位不扣分,化简也可以)
本题解析:(1)明矾的焙烧已经给出了方程式,因此本题主要是考查氧化还原反应的特征。该方程式中发生化合价变化的只有S元素,明矾中的S元素一部分发生化合价降低,而S单质的化合价升高,因此反应中的氧化剂是明矾(KAl(SO4)2·12H2O),还原剂是单质S。
(2)步骤②是水浸明矾焙烧后的固体混合物,因此要提高浸出率,往往需要增大接触面积、充分溶解;因此粉碎固体混合物、不断搅拌都是可行的。
(3)焙烧后的固体混合物是K2SO4和Al2O3,水浸后的溶液则是易溶于水的K2SO4溶液,所以要从单一组分的溶液中得到改溶质,可以直接蒸发结晶。
(4)氧化铝电解制备铝单质,该反应方程式为 ;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
(5)以Al和NiO(OH)为电极构成的碱性电池,首先判断出单质Al做负极,NiO(OH)为正极;因此放电时正极得到电子被还原,从Ni的化合价变化可以得出得失电子数目,所以充分运用电荷守恒、原子守恒,再结合反应环境可以的该正极的反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH-。
(6)计算思路:计算明矾物质的量,根据方程式计算SO2的总物质的量,根据S原子守恒H2SO4溶质的物质的量等于96%的SO2,把溶质H2SO4的物质的量转化为质量,再用溶质H2SO4的质量除以质量分数求得H2SO4溶液的总质量。计算列式为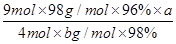 。
。
本题难度:一般
3、选择题 铝能用于作铝热剂和冶炼难熔金属的原因是(? )
A.铝的导热性很好
B.在高温下能燃烧
C.还原性较强且在反应中放出大量的热
D.金属性较强
参考答案:C
本题解析:铝的还原性强,且还原其他金属时放出大量的热,故常用于冶炼难熔金属。
本题难度:简单
4、填空题 某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。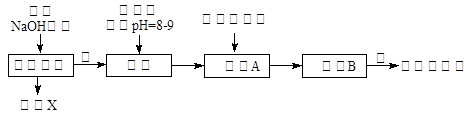
(1)镁铝合金中加NaOH溶液的离子反应方程式为?,画出金属X的原子结构示意图?,固体A的化学式为?;
(2)写出硫酸铝在水中的电离方程式 ??,操作②包含的步骤有蒸发浓缩、?、过滤、干燥。
(3)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图装置,则需要测定的数据有? 、??。 
参考答案:(1)2Al+2OH-+2H2O=2AlO2-+3H2↑[2分] Mg?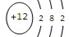 ?[2分]Al(OH)3 [1分]?
?[2分]Al(OH)3 [1分]?
(2)Al2(SO4)3=2Al3++3SO42-[2分]?冷却结晶(降温结晶) [1分]
(3)氢气的体积、镁铝合金的质量(温度、大气压强)(答到前2个条件给满分)[各1分,共2分]
本题解析:(1)镁铝合金中铝与NaOH溶液反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,所以X是镁,原子结构示意图为: 滤液为偏铝酸钠的溶液,加酸后生成氢氧化铝的沉淀,A为Al(OH)3
滤液为偏铝酸钠的溶液,加酸后生成氢氧化铝的沉淀,A为Al(OH)3
(2)硫酸铝是易溶强电解质,完全电离,Al2(SO4)3=2Al3++3SO42-,由溶液得到晶体需经过蒸发浓缩、冷却结晶(或降温结晶)、过滤、干燥
(3)测定镁铝合金中各组成的质量分数须知道外界条件、氢气的体积(即量筒内排出水的体积)、合金的质量
本题难度:一般
5、选择题 两分铝屑,一份与过量盐酸反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为
A.1:1
B.1:2
C.1:3
D.2:1
参考答案:B
本题解析:盐酸与氢氧化钠溶液是过量的,因此反应中铝完全溶解。在反应中铝均是失去3个电子,所以根据电子守恒并依据产生的H2体积比为1:2可知,两份铝屑的质量比为1:2,答案选B。
本题难度:一般