时间:2017-03-02 23:49:12
1、填空题 将一块铝硅合金恰好与NaOH溶液完全反应而溶解。
(1)写出合金溶解的离子方程式______________________________________________。
(2)向所得的溶液中加入足量的盐酸,充分反应后,溶液中大量存在的离子为_______。
参考答案:(1)Si+2OH-+H2O===SiO32-+2H2↑? 2Al+2OH-+2H2O===2AlO2-+3H2↑
(2)Na+、H+、Al3+、Cl-
本题解析:铝和硅都能与NaOH溶液反应,分别生成NaAlO2、Na2SiO3和H2;当加入盐酸时,NaAlO2与酸反应生成NaCl、AlCl3、H2O,而Na2SiO3与盐酸反应,生成不溶于水的白色沉淀。
本题难度:一般
2、选择题 将5.1g镁铝合金投入到500mL 2 mol/L的盐酸中,金属完全溶解,再加入250mL的NaOH溶液,若要使生成的沉淀最多,则应加入的这种NaOH溶液的物质的量浓度是( )
A.1mol/L
B.2mol/L
C.3mol/L
D.4mol/L
参考答案:D
本题解析:略
本题难度:一般
3、实验题 (15分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:①2Mg+O2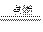 2MgO;②3Mg+N2
2MgO;②3Mg+N2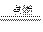 Mg3N2;
Mg3N2;
③2Mg+CO2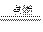 2MgO+C?④Mg+H2O
2MgO+C?④Mg+H2O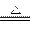 MgO+H2↑?⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
MgO+H2↑?⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。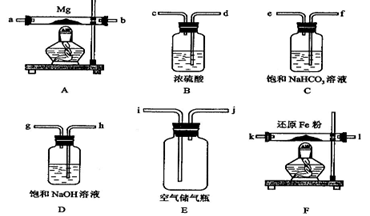
回答下列问题;
(1)?在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
| 装置 | ?目的 |
| ? | ? |
| ? | ? |
| ? | ? |
| ? | ? |
 ?;
?;参考答案:
本题解析:略
本题难度:一般
4、计算题 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58 g白色难溶物析出,向所得溶液中逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如右图所示: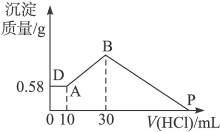
(1)混合物中NaOH的质量是___________g,AlCl3的质量是___________g,MgCl2的质量为___________g。
(2)P点表示盐酸加入的体积为___________mL。
参考答案:(1)2.6? 1.335? 0.95?(2)130
本题解析:(1)由图可知,三种物质混合时有0.58 g沉淀,当向此混合物中加入10 mL盐酸时,沉淀质量不变,说明混合物中NaOH过量,该沉淀是Mg(OH)2,由镁元素守恒可知:n(MgCl2)=n〔Mg(OH)2〕=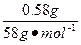 ="0.01" mol,故m(MgCl2)="0.01" mol×95 g·mol-1="0.95" g。由以下关系得:
="0.01" mol,故m(MgCl2)="0.01" mol×95 g·mol-1="0.95" g。由以下关系得:
2NaOH?—? MgCl2—Mg(OH)2
0.02 mol? 0.01 mol
AlCl3?—? NaAlO2—HCl
0.01 mol?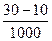 ×0.5 mol·L-1="0.01?" mol
×0.5 mol·L-1="0.01?" mol
m(AlCl3)="0.01" mol×133.5 g·mol-1="1.335" g
由图可知,B点是沉淀量最大点,此时溶液中溶质只有NaCl,由元素守恒可知:
n(NaOH)=n(HCl)+2n(MgCl2)+3n(AlCl3)="0.5" mol·L-1×0.03 L+2×0.01 mol+3×0.01 mol="0.065" mol,所以,m(NaOH)="0.065" mol×40 g·mol-1="2.6" g。
(2)由图可知,P点时Al(OH)3、Mg(OH)2沉淀恰好全部溶解在盐酸中,溶质为NaCl、AlCl3、MgCl2,所以,此时溶解Al(OH)3、Mg(OH)2沉淀恰好消耗盐酸:
V(HCl)=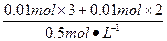 ="0.1" L="100" mL。
="0.1" L="100" mL。
由此可知,P点时,V(HCl)="30" mL+100 mL="130" mL。
本题难度:简单
5、简答题 某中学有甲、乙两个探究性学习小组,他们拟用小颗粒的铝铜合金与足量的稀硫酸反应测定通常状况(约20℃、1.01×105Pa)下的气体摩尔体积(Vm).
(一)甲组同学拟设计如图1所示的装置来完成实验.
(1)写出装置I中发生反应的离子方程式:______.
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻旋开其活塞,一会儿后发现稀硫酸不能顺利滴入锥形瓶中.请帮助他们分析其原因:______.
(3)实验结束时,生成氢气的体积近似等于:______.
(4)锥形瓶中残存的氢气对实验结果是否有影响:______(填“有”、“没有”、或“不能判断”),简述理由:______.
(二)乙组同学仔细分析了甲组同学的实验装置后以为,稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶中的空气排出,使所测氢气的体积偏大;实验结束后,连接广口瓶
和量筒的导管中有少量水存在,使所测氢气的体积偏小.于是他们设计了如图2所示的实验装置.
(1)装置中导管a的作用是:______.
(2)实验中准确测定出4个数据,如下表:
| 实验前 | 实验后 铝铜合金质量(g) m1 m2 量液管(C)体积(mL) V1 V2 |
参考答案:(一)
(1)铝和稀硫酸反应生成硫酸铝和氢气,其离子方程式为:2Al+6H+=2Al3++3H2↑.
故答案为:2Al+6H+=2Al3++3H2↑.
(2)铝与稀硫酸反应产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,所以稀硫酸不能顺利滴入锥形瓶中.
故答案为:铝与稀硫酸反应产生的氢气使锥形瓶内气压增大.
(3)气体产生的压强导致水从集气瓶中排出,且氢气不易溶于水,所以收集到的水的体积近似等于氢气的体积.
故答案为:收集到水的体积近似等于氢气的体积.
(4)装置中有空气存在,生成的氢气不溶于水,在相同温度和压强下,参与氢气的体积与排出空气的体积相等,
所以没有影响.
故答案为:没有、相同温度和压强下,参与氢气的体积与排出空气的体积相等
(二)
(1)铝与稀硫酸反应产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,导管a使锥形瓶内的气体进入分液漏斗上方,使分液漏斗上方的压强增大,稀硫酸顺利滴下.
故答案为:平衡锥形瓶与分液漏斗内的压强,使稀硫酸顺利滴下.
(2)2Al+6H+=2Al3++3H2↑.
? 2mol? 3mol
?
m1-m227mol?(V2-V1)×10-3Vmmol
Vm=9(V2-v1)500(m1-m2)L/mol
?故答案为:9(V2-V1)500(m1-m2)L/mol
本题解析:
本题难度:一般