时间:2017-03-02 23:44:55
1、填空题 (1)已知在25℃时:
①2CO(s)+ O2(g)==2CO2(g) △H1=-566KJ/mol
②C(s)+O2(g)==CO2(g) △H2=-394KJ/mol,
则碳与氧气反应生成一氧化碳的热化学方程式为:_____________________________;
(2)在体积为2 L的密闭容器中,A与B在一定条件下反应生成C:A(g)+2B(s) 2C (g)。反应达到平衡时,平衡常数表达式K= ____________ ;在不同温度下达到平衡时生成物C的物质的量如下图所示,则该反应是____________反应(填“放热”或“吸热” )。在500℃,从反应开始到平衡,C的平均反应速率v(C) =___________________。
2C (g)。反应达到平衡时,平衡常数表达式K= ____________ ;在不同温度下达到平衡时生成物C的物质的量如下图所示,则该反应是____________反应(填“放热”或“吸热” )。在500℃,从反应开始到平衡,C的平均反应速率v(C) =___________________。 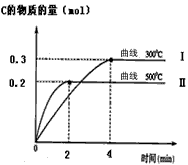
2、填空题 把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)  CO2(g) (1mol碳单质反应放热Q1 kJ)
CO2(g) (1mol碳单质反应放热Q1 kJ)
途径Ⅱ:先制水煤气 C(s)+H2O(g) CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
再燃烧水煤气 2CO(g)+O2(g)  2CO2(g)
2CO2(g)
2H2(g)+O2(g) 2H2O(g) (1molCO和1molH2反应共放热Q3 kJ)
2H2O(g) (1molCO和1molH2反应共放热Q3 kJ)
试回答下列问题:
(1)当等物质的量的单质碳反应时,途径Ⅰ放出的热量_________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)Q1 、Q2 、Q3 的数学关系式是__________________。
(3)由于制取水煤气反应是吸热反应,所以反应物所具有的总能量________(填“大于”、“等于”或“小于”)生成物所具有的总能量。
(4)简述煤通过途径Ⅱ作为燃料的意义:_____________。
3、简答题 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料(已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol).同时它也可以作为制冷剂而替代氟氯代烃.工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚;
2CH3OH
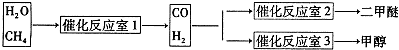
4、选择题 25℃、101kPa下:
①2Na(s)+1/2O2(g)=Na2O(s) △H= -414kJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H= -511kJ/mol
下列说法正确的是
[? ]
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s) △H= -317kJ/mol
5、选择题 已知:(1)Zn(s)+
| 1 2 |
| 1 2 |