时间:2017-03-02 23:13:03
1、填空题 在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | ? | ? | ? |
| 平衡移动方向 | ? | ? | ? |
参考答案:
逆向
正向
逆向
减小
减小
增大
本题解析:氨水中存在NH3+H2O NH3?H2O
NH3?H2O NH4++OH-,向氨水中加入少量硫酸铵,硫酸铵电离出铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;向氨水中加入少量硝酸,氢离子和氢氧根离子反应,导致氢氧根离子浓度减小,促进氨水电离,平衡向右移动;向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向左移动,故答案为:
NH4++OH-,向氨水中加入少量硫酸铵,硫酸铵电离出铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;向氨水中加入少量硝酸,氢离子和氢氧根离子反应,导致氢氧根离子浓度减小,促进氨水电离,平衡向右移动;向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向左移动,故答案为:
加入的物质
少量(NH4)2SO4固体
少量HNO3溶液
少量KOH溶液
c(OH-)的变化
减小
减小
增大
平衡移动方向
逆向
正向
逆向
本题难度:一般
2、填空题 (6分)写出下列物质在水溶液中的电离方程式或离子水解方程式。
1、写出下列三种物质的电离方程式
(1) HClO ??。
(2)CH3COONa ??。
(3)NH3·H2O??。?
2、写出下列三种物质的离子水解方程式
(4)CH3COONa ??。
(5)NH4Cl??。
(6)NaF??。
参考答案:(6分)(每小题1分)(1)? HClO? ?H+? +? ClO-?
?H+? +? ClO-?
(2) CH3COONa =CH3COO-?+? Na+?(3) NH3·H2O  ?NH4+?+? OH-?
?NH4+?+? OH-?
(4) CH3COO- + H2O  ?CH3COOH + OH-
?CH3COOH + OH-
(5) NH4+ + H2O  ?NH3·H2O + H+?(6) F- + H2O?
?NH3·H2O + H+?(6) F- + H2O? ?HF + OH-
?HF + OH-
本题解析:醋酸钠是强电解质,用等号连接,次氯酸和氨水都是弱电解质,用可逆号连接,因此正确的电离方程式是(1)? HClO H+ + ClO-;(2) CH3COONa =CH3COO-?+ Na+?;(3) NH3·H2O
H+ + ClO-;(2) CH3COONa =CH3COO-?+ Na+?;(3) NH3·H2O  ?NH4+?+? OH-;醋酸钠和氟化钠都是强碱弱酸盐,水解显碱性。氯化铵是强酸弱碱盐,水解显酸性。由于水解都是可逆的,所以水解方程式分别是(4) CH3COO- + H2O
?NH4+?+? OH-;醋酸钠和氟化钠都是强碱弱酸盐,水解显碱性。氯化铵是强酸弱碱盐,水解显酸性。由于水解都是可逆的,所以水解方程式分别是(4) CH3COO- + H2O  ?CH3COOH + OH-;(5) NH4+ + H2O
?CH3COOH + OH-;(5) NH4+ + H2O  ?NH3·H2O + H+;(6) F- + H2O?
?NH3·H2O + H+;(6) F- + H2O? ?HF + OH-。
?HF + OH-。
点评:书写电离方程式时首先要判断电解质的强弱,然后在依据具体的电解质书写;而水解方程式的书写,则需要注意水解反应一般都是可逆的,其次还要注意多元弱酸根以及多元弱碱离子的不同。再就是水解的程度一般都很小,一般不能标出“↑”或“↓”。
本题难度:一般
3、选择题 下列各溶液中,叙述正确的是
A.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的大小关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.将0.1mol/L醋酸溶液加大量水稀释后,溶液的pH增大
D.Na2CO3溶液中:c(Na+ )="2c" (CO32- ) + c (HCO3- ) + c (H2CO3 )
参考答案:C
本题解析:A、硫酸铵是强酸弱碱盐,NH4+水解溶液显酸性,但水解程度很小,NH4+浓度大于SO42-浓度,即c(NH4+)>c(SO42-)>c(H+)>c(OH-),A不正确;B、盐酸是强酸,氨水是弱碱,因此25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后氨水过量,溶液显碱性,溶液中离子浓度的大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+),B不正确;C、醋酸是弱酸存在电离平衡,稀释促进电离,但溶液的酸性仍然是减小的,所以将0.1mol/L醋酸溶液加大量水稀释后,溶液的pH增大,C正确;D、根据物料守恒可知Na2CO3溶液中:c(Na+ )="2c" (CO32- ) + 2c (HCO3- ) + 2c (H2CO3 ),D不正确,答案选C。
本题难度:一般
4、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)  H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色?黄色
浓度为0.02 mol·L-1的下列各溶液:①盐酸②石灰水③NaCl溶液?④NaHSO4溶液?⑤NaHCO3溶液?⑥氨水,其中能使指示剂显红色的是(?)
A.①④⑤
B.②⑤⑥
C.①④
D.②③⑥
参考答案:C
本题解析:根据方程式可知,要使指示剂显红色,则平衡应该向逆反应方向进行。所以根据方程式可知,增大氢离子浓度可以使平衡向逆反应方向进行,溶液显红色,答案选C。
本题难度:一般
5、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、
B.加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、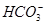
C.水电离产生的c(H+)=10-13mol·L-1的溶液中:Na+、Cl-、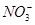 、
、
D.0.1 mol·L-1HNO3溶液中:Mg2+、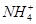 、Fe2+、Cl-
、Fe2+、Cl-
参考答案:C
本题解析:滴入酚酞溶液显红色的溶液呈碱性,Cu2+不能存在,A项错误;虽然加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀,但是Al3+、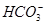 不能共存,B项错误;Na+、Cl-、
不能共存,B项错误;Na+、Cl-、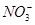 、
、 无论在酸性或碱性条件下都能共存,C项正确;在HNO3溶液中Fe2+被氧化,D项错误。
无论在酸性或碱性条件下都能共存,C项正确;在HNO3溶液中Fe2+被氧化,D项错误。
本题难度:一般