时间:2017-03-02 23:13:03
1、选择题 常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是( )
A.若c(OH-)>c(H+),则a=b
B.若c(K+)>c(CH3COO-),则a>b
C.若c(OH-)=c(H+),则a>b
D.若c(K+)<c(CH3COO-),则a<b
参考答案:D
本题解析:若a=b,则溶质为醋酸钾,c(K+)>c(CH3COO-),c(OH-)>c(H+);
若a>b,则溶质为醋酸和醋酸钾,溶液可能呈酸性,c(OH-)<c(H+),c(K+)<c(CH3COO-);也可能呈中性,c(OH-)=c(H+),c(K+)=c(CH3COO-);也可能呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-);
若a<b,则溶质为醋酸钾和氢氧化钾,溶质呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-)。
点评:分类讨论思想的应用。
本题难度:一般
2、选择题 常温下向10 mL 0.1mol·L
参考答案:
本题解析:
本题难度:一般
3、选择题 甲、乙两烧杯中分别盛有10mL?1mol?L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水.下列有关两个烧杯的说法中,正确的是( )
A.甲中产生的沉淀一定比乙中多
B.乙中产生的沉淀一定比甲中多
C.甲和乙产生的沉淀一定一样多
D.甲和乙中产生的沉淀可能一样多
参考答案:D
本题解析:
本题难度:简单
4、选择题 (2我c4?广州一模)对于常温下我.cmol?L-c氨水和我.cmol?L-c醋酸,下列说法正确的是( )
A.0.1mol?L-1氨水,溶液的pH=13
B.0.1mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小
C.0.1mol?L-1醋酸溶液中:c(H+)=c(CH3COO-)
D.0.1mol?L-1醋酸与0.1mol?L-1 NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:A.一水合氨是弱电解质,在水溶液里部分电离,所以氨水溶液中存在一水合氨电离平衡,则0.3mo3?3-3氨水,溶液的pH<33,故A错误;
B.加水稀释促进一水合氨电离,氢氧根离子增多t数小于溶液体积增大倍数,所以溶液中氢氧根离子浓度减小,温度不变,水的离子积常数不变,则氢离子浓度增大,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-),故C错误;
D.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐,其溶液呈碱性c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO-),盐类水解较微弱,所以c(CH3COO-)>c(OH-),该溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选D.
本题解析:
本题难度:一般
5、填空题 (16分)(1)写出下列物质在水溶液中电离的方程式
HNO3 HClO
NaHCO3
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是_________________。
②H2的燃烧热为_______________,C的燃烧热为__________________.
③燃烧l0gH2生成液态水,放出的热量为_________________.
④CO的燃烧热为___________,其热化学方程式为_____________ __________.
参考答案:(1)HNO3=H++NO3- HClO H++ClO- NaHCO3=Na++HCO3- HCO3-
H++ClO- NaHCO3=Na++HCO3- HCO3- H++CO32-
H++CO32-
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=" -725.76" kJ·mol-1 (3)①: ①②③④
②285.8 kJ·mol-1 393.5 kJ·mol-1 ③1429 kJ ④283 kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH=" -283" kJ·mol-1
本题解析:
试题解析:(1)HNO3为强电解质,完全电离,电离方程式为HNO3=H++NO3-, HClO为一元弱酸不完全电离,电离方程式为HClO H++ClO-,NaHCO3为强电解质,完全电离,电离方程式为NaHCO3=Na++HCO3- HCO3-
H++ClO-,NaHCO3为强电解质,完全电离,电离方程式为NaHCO3=Na++HCO3- HCO3- H++CO32-;(2)1g甲醇燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热22.68kJ×32=725.8KJ,燃烧热热化学方程式为:CH3OH(l)+
H++CO32-;(2)1g甲醇燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热22.68kJ×32=725.8KJ,燃烧热热化学方程式为:CH3OH(l)+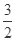 O2(g)
O2(g)
本题难度:一般