时间:2017-03-02 22:53:16
1、选择题 有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。已知空气的平均相对分质量为29,则A的相对分子质量是 ( )
A.29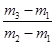
B.29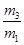
C.29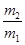
D.29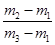
参考答案:A
本题解析:真空瓶质量为m1,该瓶充入空气后质量为m2.令气体的物质的量为n,则:m1g+n×29g/mol=m2g,n=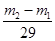 ,在相同状况下,若改为充入某气体A时,总质量为m3.所以A的质量为(m3-m1)g,物质的量为
,在相同状况下,若改为充入某气体A时,总质量为m3.所以A的质量为(m3-m1)g,物质的量为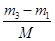 ,同温同压下,空气和A气体的物质的量相等,故
,同温同压下,空气和A气体的物质的量相等,故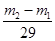 =
=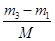 ,M=29
,M=29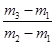 ,答案选A.
,答案选A.
考点:物质的量的有关计算
本题难度:一般
2、选择题 将Na、Mg、Al各0.3mol分别放入100mL、1mol/L的HCl中,同温同压下产生的气体的体积比是
A.3:1:1
B.6:3:2
C.1:2:3
D.1:1:1
参考答案:A
本题解析:等物质的量的Na、Mg、Al各0.3mol与盐酸反应,Na消耗的HCl的物质的量最少,则0.3molNa需要0.3molHCl,而100mL、1mol/L的HCl中只有0.1molHCl,所以HCl不足,对于Mg、Al而言,不能与冷水反应产生氢气,所以二者产生的氢气的物质的量都是HCl的物质的量的一半是0.05mol,Na还与水对于放出氢气,所以Na无剩余,根据2Na~H2,所以Na反应放出的氢气的物质的量是0.3mol/2=0.15mol,所以同温同压下产生的气体的体积比也是物质的量之比是0.15mol:0.05mol:0.05mol=3:1:1,答案选A。
考点:考查Na、Mg、Al的化学性质及与酸反应的计算
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.1 mol H2SO4的质量为98g·mol-1
B.H2SO4的摩尔质量为98g
C.6.02×1022个H2SO4分子的质量为9.8g
D.9.8 g H2SO4含有6.02×1023个H2SO4分子
参考答案:
本题解析:A错,质量的单位为g;B错,摩尔质量的单位为g·mol-1;C正确,6.02×1022个H2SO4分子的物质的量不0.1mol,其质量为9.8g;D错,9.8 g H2SO4含有6.02×1022个H2SO4分子
本题难度:简单
4、选择题 三种正盐的混合溶液中含有0.2molNa+,0.25molMg2+,0.4molCl-,则SO42-的物质的量为( )
A.0.1?mol
B.0.3?mol
C.0.5?mol
D.0.15?mol
参考答案:溶液呈电中性,根据电荷守恒有n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),故
0.2mol×1+0.25mol×2=1×0.4mol+2n(SO42-)
解得:n(SO42-)=0.15mol,
故选D.
本题解析:
本题难度:一般
5、选择题 设NA为阿伏加德罗常数,下列说法中正确的是
A.NA个氢气分子所占的体积为22.4L
B.2NA个二氧化碳分子的质量为44g
C.1000mL0.1mol/L 的NaCl溶液中, 与
与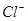 离子总数为0.2NA
离子总数为0.2NA
D.17g氨气中所含原子数为NA
参考答案:C
本题解析:阿伏伽德罗常数NA在含义上就是指1mol粒子的粒子数.或者1NA粒子的物质的量就是1mol。
A、没表明标准状况下,不能用22.4L/mol,所以A错误;
B、2NA个二氧化碳分子,也就是2mol,即其的质量为88g,所以错误;
C、NaCl溶液中的电解质NaCl是全部电离的,所以正确;
D、17g氨气中所含原子数为3NA,所以错误。
故选C。
点评:题主要考查了物质的量微粒数、阿伏伽德罗常数、质量等定量关系,一般求粒子的质量或微粒数要通过物质的量这个桥梁。
本题难度:一般