时间:2017-03-02 22:53:16
1、填空题 100mL 1 mol/LAl2(SO4)3溶液中,Al3+物质的量浓度是 ,含Al3+物质的量 mol,从其中取10ml,Al2(SO4)3物质的量浓度是 ,再将这10ml溶液稀释成100ml,物质的量浓度又为 。Al3+与SO42-物质的量浓度之比是 。
参考答案:2mol/L,0.2mol,1mol/L,0.1mol/L,2:3.
本题解析: 铝离子浓度为1mol/L×2=2mol/L,含有的铝离子的物质的量为2mol/L×0.1L=0.2mol,从其中取出一部分,物质的量浓度不变,是1mol/L,将溶液稀释后浓度为1mol/L×0.01L÷0.1L=0.1mol/L,铝离子和硫酸根的浓度比等于2:3.
考点:物质的量浓度的计算。
本题难度:一般
2、填空题 设NA 代表阿伏加德罗常数的数值,下列说法正确的是
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.标准状况下,NA个SO3分子所占的体积约为22.4 L
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
参考答案:C
本题解析:略
本题难度:一般
3、选择题 用1molMnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量
A.等于2mol
B.等于1mol
C.小于1 mol
D.大于2 mol
参考答案:C
本题解析:浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题。反应的化学方程式为:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol,所以答案选C。
MnCl2+Cl2↑+2H2O,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol,所以答案选C。
考点:考查氯气实验室制备的有关判断和计算
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。明确随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应是答题的关键,有利于培养学生的逻辑推理能力。
本题难度:简单
4、实验题 某学生在实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制0.1mol/L盐酸溶液250mL,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。该生用量筒量取盐酸体积_________mL,除量筒外还需要的其它仪器:_________。
(2)该学生配制前设计了下列操作,其合理的操作顺序是_________(字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3) 操作A中,将洗涤液都需移入容量瓶,其目的是:______________________。将溶液注入容量瓶前需冷却到室温,这是因为:________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.加蒸馏水时不慎超过了刻度_________;
b.定容时俯视_________;
C.在操作B中若用水洗涤量筒2-3次,并将洗涤液一并倒入烧杯中_________;
(5)若实验过程中出现如下情况应该如何处理? 向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? _________________。
参考答案:(1)2.1;250mL容量瓶、烧杯、玻璃棒、胶头滴管
(2)BCAFED
(3)将溶质全部转移到容量瓶,避免配制成的溶液浓度偏小;容量瓶只能在室温下使用,溶液高于常温溶液体积膨胀所配溶液浓度偏大
(4)a:偏低;b:偏高;c:偏高
(5)重新配制
本题解析:
本题难度:一般
5、选择题 相同质量的SO2和SO3,下列关系正确的是
A.含氧原子个数比为2:3
B.含硫元素质量比为4:5
C.含氧元素质量比为5:6
D.含硫原子个数比为1:1
参考答案:C
本题解析:相同质量的SO2和SO3,分子的物质的量之比为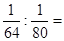 5:4,所以氧原子个数比为5×2: 4×3=5:6,故A错误;分子的物质的量之比为5:4,所以硫元素质量比为5:4,故B错误;氧原子个数比为5:6,故C正确;分子的物质的量之比为5:4,所以硫原子个数比为5:4,故D错误。
5:4,所以氧原子个数比为5×2: 4×3=5:6,故A错误;分子的物质的量之比为5:4,所以硫元素质量比为5:4,故B错误;氧原子个数比为5:6,故C正确;分子的物质的量之比为5:4,所以硫原子个数比为5:4,故D错误。
考点:本题考查物质的量。
本题难度:一般