时间:2017-03-02 22:39:05
1、选择题 下列晶体中含有非极性共价键的离子晶体是(?)
①硅晶体?②H2O2?③CaC2?④NH4Cl?⑤Na2O2?⑥苯酚钠
A.①②④⑥
B.①③
C.②④⑤⑥
D.③⑤⑥
参考答案:D
本题解析:晶体硅是含有非极性键的原子晶体,双氧水是含有极性键和非极性键的分子晶体,CaC2是含有离子键和非极性键的离子晶体,氯化铵是回家离子键和极性键的廉政教育过氧化钠是含有离子键和非极性键的离子晶体,苯酚钠是含有离子键、极性键和非极性键的离子晶体,因此正确的答案选D。
本题难度:一般
2、推断题 H、C、N、O、都属于自然界中常见非金属元素。
(1)O、C、N三种元素的第一电离能由小到大顺序是?;NH4+中氮原子轨道的杂化类型为________。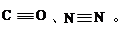 (2)CO、N2的结构可表示为:?
(2)CO、N2的结构可表示为:?
两者的键能数据:(单位kJ/mol)
| ? | A—B | A=B | 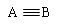 |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
参考答案:(8分)
(1)C O N?(1分) ;sp3杂化(1分)
(2)CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。(2分)
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,在气化时要破坏氢键,所以需要更多能量,沸点前者较高。
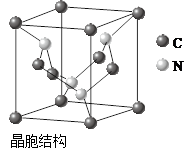
(4)C3N4(2分)
本题解析:
(1)由于N原子最外层是半充满结构,能量比较低,难以失电子,所以第一电离能比相邻原子的大,故顺序为C O N?;根据价层电子对互斥理论可以NH4+中氮sp3杂化;
(2)根据表中的数据可知:CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂。
(3)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键。
(4)晶胞中微粒数计算为:碳,8*11/8+4*1/2=3,氮:4个,故化学式为C3N4。
本题难度:一般
3、选择题 水是生命之源,下列关于水的表达正确的是
A.H2O分子的比例模型
B.H2O和D2O与互为同分异构体
C.H2O分子和H2S分子都是极性分子
D.H2O沸点高于H2S,是因为O—H键比S—H键键能高
参考答案:C
本题解析:A不正确,该模型是球棍模型;分子式相同,结构不同的化合物互为同分异构体,B不正确;H2O分子和H2S分子都是V型结构,属于极性分子,C正确;水分子间存在氢键。所以,所以水的沸点高于H2S的,与分子中的化学键无关系,D不正确,答案选C。
点评:该题紧密联系生活实际,有利于调动学生的学习兴趣,激发学生的学习积极性,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。
本题难度:一般
4、填空题 镍(Ni)可形成多种配合物,且各种配合物均有广泛的用途。
(1)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;写出两种与配体CO互为等电子体的粒子的化学式________、________。
(2)某镍配合物结构如下图所示,分子内含有的作用力有________(填序号)。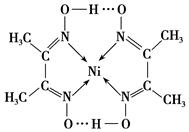
A.氢键
B.离子键
C.共价键
D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应,如
① ?②
?② 、③
、③ 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________?。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________?。
(4)据报道,含有镁、镍和碳三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为________。晶体中每个镁原子周围距离最近的镍原子有________个。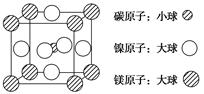
参考答案:(共12分) (1)分子?(1分)?N2(1分)CN-(1分)? (2)ACE(2分)
(3)①③④(2分) 平面三角形(1分)? (4)MgNi3C(2分) 12(2分)
本题解析:(1)根据相似相溶原理可知,化合物是非极性分子,所以形成的晶体是分子晶体。电子数和原子数分布都相等的分子是等电子体,所以和CO互为等电子体的是氮气或CN-。
(2)根据配合物结构可判断,分子中不存在离子键和金属键,所以答案选ACE。
(3)①③④都是平面型结构,所以是sp2杂化。乙炔是直线型结构,是sp杂化。HCHO分子中碳原子没有孤对电子,是sp2杂化,所以是平面三角形结构。
(4)根据晶胞的结构可知,碳原子全部在晶胞中,共有1个。镁原子在面心处,共有6×1/2=3个。镍原子在顶点处,共有8×1/8=1个,所以化学式为MgNi3C。晶体中每个镁原子周围距离最近的镍原子位于面心处,所以共有3×8÷2=12个。
本题难度:一般
5、选择题 下列化合物中,含有非极性键的离子化合物是( )
A.MgCl2
B.Ba(OH)2
C.Na2O2
D.H2O2
参考答案:C
本题解析:
本题难度:一般