时间:2017-02-07 17:18:37
1、选择题 铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如下: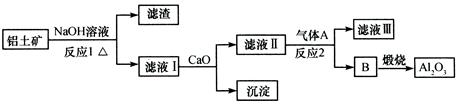
下列说法正确的是
A.气体A一定为HCl
B.滤液Ⅰ中溶质仅含NaAlO2
C.沉淀的主要成分为硅酸钙
D.反应1、反应2均不是氧化还原反应
参考答案:CD
本题解析:
试题分析:A.气体A一定为HCl,只要酸性强于偏铝酸均可以,最好是二氧化碳气体,不会引入新的杂质,错误;B.滤液Ⅰ中溶质仅含NaAlO2还有剩余的氢氧化钠,错误;C.硅酸钠和钙离子反应生成沉淀的主要成分为硅酸钙,正确;D.反应1、反应2均不是氧化还原反应,正确;
本题难度:一般
2、选择题 某无色溶液中,已知含有H+、Al3+、Mg2+等阳离子,逐渐加入NaOH溶液,则消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系可用下图来表示,则下列关系正确的是(???)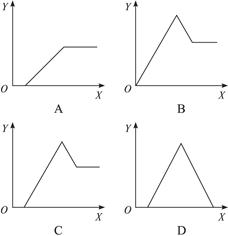
参考答案:C
本题解析:无色溶液中加入氢氧化钠溶液时,OH-首先与H+反应,无沉淀生成,然后再与Al3+、Mg2+作用形成沉淀,沉淀处于最高点时Al3+、Mg2+全部以氢氧化物析出,继续加碱时,由于氢氧化铝具有两性会继续溶解,而氢氧化镁不能溶解,故A、B、D三项均不正确。
本题难度:简单
3、填空题 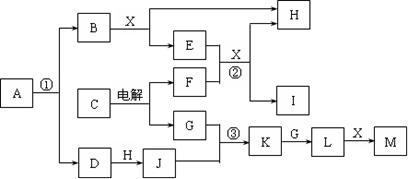 下图所示各物质均由短周期元素组成,部分反应的产物略去。A的摩尔质量为65g/mol,B、F为金属单质,D、H、G为无色气态非金属单质,C、K、L和X都属于氧化物,E、J、M均为重要的化工产品。
下图所示各物质均由短周期元素组成,部分反应的产物略去。A的摩尔质量为65g/mol,B、F为金属单质,D、H、G为无色气态非金属单质,C、K、L和X都属于氧化物,E、J、M均为重要的化工产品。
回答下列问题:
⑴ X的电子式为? ▲?。???????????????? ⑵反应②的离子方程式为? ▲?。
⑶反应③的化学方程式为? ▲?。????????? ⑷A的化学式为? ▲?。
参考答案:⑴ 本题解析:本题题眼不清楚,要求对于常见物质及其反应非常熟悉。几个方面不可缺少:一是对常见的电解熟知,诸如氯碱工业、铝单质制备;二是对常见化工产品要能列举,诸如氯碱工业制氢氧化钠、工业合成氨、工业制备硝酸等;三是要会分析常见的摩尔质量,诸如CaC2为64g/mol、COS为60g/mol等。本题要能根据各种信息想到NaN3为65g/mol,则一马平川(N3—在平时练习时注意积累,物质结构题经常出现)。
本题难度:一般
4、推断题 A.B、C、D是原子序数依次增大的短周期元素,化合物AC2与B2C具有相同的电子数,A、B的质子数之和与D的质子数相同,D与C形成的化合物既能与强酸反应又能与强碱反应,回答下列问题:
(1)写出D的原子结构示意图_________,AC2的电子式___________。
(2)写出D与C形成的化合物与强碱反应的离子方程式____________________。
(3)14g、化合物AC与足量的C2单质反应放出141.5 kJ的热量,该反应的热化学方程式为____________。
(4)B的最高氧化物对应的水化物M,M与第四周期常见金属X有如下转化关系
写出Y与M的稀溶液反应的离子方程式____________________。Z溶液显_______性,其原因用离子方程式表示为____________________。
参考答案:(1)本题解析:
本题难度:一般
5、选择题 能说明镁的金属性比铝强的理由有
A.镁原子最外电子层上有2个电子,铝原子最外电子层上有3个电子
B.Mg(OH)2呈碱性,而Al(OH)3呈两性
C.镁的熔沸点低于铝的熔沸点
D.镁的硬度不如铝
参考答案:B
本题解析:
正确答案:B
金属性:金属气态原子失去电子能力的性质。能说明金属性强弱的方法有:
1、同周期中,从左到右,随着核电荷数的增加,金属性减弱;同主族中,由上到下,随着核电荷数的增加,金属性增强。
2、依据最高价氧化物的水化物碱性的强弱:碱性越弱,其元素的金属性也越强。
3、依据金属活动顺序表(极少数例外)
4、常温下与酸反应的剧烈程度。
5、常温下与水反应的强烈程度。
6、与盐溶液之间的置换反应。
7、高温下与金属氧化物间的置换反应。
8、用电化学
本题难度:简单