时间:2017-02-07 17:18:37
1、填空题 铝可以制成铝箔是利用了铝的____________性;铝比铁不容易生锈的原因是铝表面较易形成__________。工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁_________。铁与水蒸气反应的化学方程式为__________________________。
参考答案:延展性;致密氧化膜。钝化。3Fe+4H2O
本题解析:
试题分析:物质的结构决定物质的性质,物质的性质决定物质的用途;铝在常温下易与氧气反应,表面形成致密的氧化物薄膜,阻止内层的铝进一步被氧化,所以铝制品“不生锈”;由于常温下,铝遇浓硫酸,浓硝酸时会在表面生成致密的氧化膜而钝化,从而阻止内部金属进一步发生反应,铁与水蒸气在高温条件下反应生成Fe3O4和氢气,方程式为3Fe+4H2O(g) 本题难度:一般
本题难度:一般
2、选择题 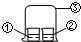 用图中所示的装置进行实验,实验现象与预测不一致的是
用图中所示的装置进行实验,实验现象与预测不一致的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A.浓氨水具有挥发性,氨气溶于水形成氨水,氨水与FeCl3溶液反应;
B.浓氨水具有挥发性,浓盐酸具有挥发性,氯化氢和氨气反应;
C.硝酸具有挥发性、强氧化性,可以将KI氧化为I2;
D.饱和亚硫酸不稳定分解产生二氧化硫,二氧化硫不能漂白指示剂.
解答:A.浓氨水具有挥发性,氨气溶于水形成氨水,氨水与FeCl3溶液反应生成氢氧化铁红褐色沉淀,故A正确;
B.浓氨水具有挥发性,浓盐酸具有挥发性,氯化氢和氨气相遇产生白烟氯化铵,故B正确;
C.硝酸具有挥发性、强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色,故C正确;
D.饱和亚硫酸不稳定分解产生二氧化硫,二氧化硫不能漂白指示剂,所以②中溶液只变红,故D错误;
故选D.
点评:本题主要考查了化学实验、元素化合物性质等,明确元素化合物的性质即可分析解答本题,难度不大.
本题难度:简单
3、选择题 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200 mL C(OH-)= 0.1mol/L的溶液,然后逐滴加入1 mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是 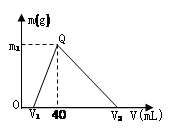
A.原合金质量为 0.92 g
B.图中V2为 60
C.整个加入盐酸过程中 Na+的浓度保持不变
D.Q点m1为1.56
参考答案:D
本题解析:
试题分析:由图象可知,向合金溶解后的溶液中加盐酸,先发生NaOH+HCl=NaCl+H2O,后发生NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,最后发生Al(OH)3+3HCl=AlCl3+3H2O,合金溶解后剩余的氢氧化钠的物质的量为0.02mol,
由NaOH+HCl=NaCl+H2O,
0.02mol?0.02mol
生成沉淀时消耗的盐酸为40mL-20mL=20mL,其物质的量为由0.02L×1mol/L=0.02mol,
由 NaAlO2+HCl+H2
本题难度:一般
4、选择题 称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出相同体积的气体,则两份铝粉的质量比为(??)
A.1:1
B.2:3
C.3:2
D.1:6
参考答案:A
本题解析:
试题分析:铝与盐酸反应的方程式为2Al+6HCl=2AlCl3+3H2↑,与烧碱溶液反应的方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可以看出,反应关系式都为2Al~3H2,同温同压下放出相同体积的气体,需要铝的物质的量相等,质量相等。
本题难度:一般
5、选择题 分别在pH=2的酸和pH=12的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
A.①②
B.②
C.②③
D.④
参考答案:①pH=2的酸中c(H+)和pH=12的NaOH溶液c(OH
本题解析:
本题难度:一般