时间:2017-02-07 15:55:44
1、选择题 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是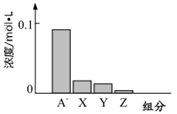
A.将HA加水稀释,溶液中所有粒子的浓度均减小
B.等浓度的HA和NaOH溶液中水的电离程度相同
C.图中X表示HA,Y表示H+,Z表示OH-
D.该混合溶液中: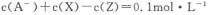
参考答案:D
本题解析:
试题分析:常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液为0.1mol/L NaA溶液,根据题给图像知,A—浓度略小于0.1mol/L,则A—发生水解,HA为弱酸,溶液中微粒浓度大小关系为:c(Na+)>c(A—) >c(OH-) >c(HA) >c(H+)。A、将HA加水稀释,溶液中氢氧根离子的浓度增大,错误;B、HA为弱酸,等浓度的HA和NaOH溶液中水的电离程度前者大于后者,错误;C、图中X表示OH-,Y表示HA,Z表示H+,错误;D、根据电荷守恒知c(Na+)+ c(H+)=c(A—) +c(OH-) ,则该混合溶液中:c(A—) +c(OH-) —c(H+)= c(Na+)=" 0.1mol/L" ,正确。
考点:考查弱电解质的电离和盐类的水解。
本题难度:困难
2、选择题 蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
A.FeCl3
B.FeCl3·6H2O
C.Fe(OH)3
D.Fe2O3
参考答案:D
本题解析:FeCl3在水中发生水解:FeCl3+3H2O Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
本题难度:一般
3、填空题 (12分)完成下列各题:
(1)在T1℃时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);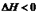 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为 ;
②可以判断上述反应在体积不变的密闭容器中,反应达到平衡的是 。
A.平均相对分子质量不变 B.V正(N2)=2V逆(NH3)
C.密闭容器中总压强不变 D.N2与H2的物质的量之比为1:3
E.反应物不再转化为生成物
③在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为 ;(填选项字母)
A.大于0.4mol B.等于0.4mol C.小于0.4mol D.不能确定
④下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2体积分数随时间t的变化曲线。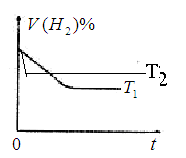
(2)已知:Al3 +与HCO3
参考答案:
本题解析:
本题难度:困难
4、填空题
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ; 实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): ________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
参考答案:(10分)(方程式2分,其余1分)
(1)酸,<,Ag
本题解析:(1)AgNO3为强酸弱碱盐,水溶液呈酸性,常温时的pH <7,原因是:Ag++ H2O  AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
(2)氯化铝为强酸弱碱盐,水溶液呈酸性,其原因是:Al3++3H2O  Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
(3)硫化钠溶液为强碱弱酸盐,水溶液呈碱性,为了防止发生水解,可以加入少量的NaOH
本题难度:一般
5、填空题 (9分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用离子方程式表示) 。
(2)下图是 0.1mol·L-1电解质溶液的pH 随温度变化的图像。
其中符合0.1mol·L-1NH4Al(SO4)2的 pH随温度变化的曲线是 (填写序号),导致 pH 随温度变化的原因是 ;
(3)室温时,向100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
①试分析图中 a、b、c、d 四个点,水的电离程度最大是 点;在 a 点,反应的离子方程式为 。
②下列对 b点时的说法正确的是 。
A.Al3+已经完全沉淀
B.c(Na+)>c(SO42-)>c(NH4+)
C.Al(OH)3部分溶解
D.消耗的 NaOH 溶液体积大于300mL
参考答案:(1)Al3+ +3H2O
本题解析:
试题分析:(1)NH4Al(SO4)2可作净水剂是因为溶于水时产生的Al3+发生水解生成有吸附性的Al(OH)3,能吸附水中的悬浮物,离子方程式为:Al3+ + 3H2O  Al(OH)3 + 3H+(2)NH4Al(SO4)2是强酸弱碱盐,发生水解使得溶液显酸性,升高温度,水解程度增大,溶液酸性增强,pH减小,故符合的图示Ⅰ。(3)①100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,先发生的反应是Al3+ + 3OH—=Al(OH)3↓ ,根据NaOH溶液的浓度和体积知道NaOH溶液量还不能完全沉淀Al3+,所以发生的反应是Al3+ + 3OH—=Al(OH)3↓,a、b、c、d四点中a点的Al3+和NH4+浓度最大,水解程度最大,所以水的电离受到的促进程度最大。②b点时如果Al3+没有完全沉淀,Al3+、NH4+水解使得溶液显酸性,现显中性说明Al3+已经完全沉淀,A对;Al3+完全沉淀时NaOH溶液的体积最小要300mL,此时Na+的物质的量比 SO42-多,故c(Na+)>c(SO42-)>c(NH4+),B对;溶液显中性时Al(OH)3不会溶解,Al(OH)3溶于强碱性溶液,不溶于中性和弱碱性溶液,C错;消耗的 NaOH 溶液等于300mL时Al3+已经完全沉淀,溶液中还有NH4+发生水解,溶液显酸性,现溶液显碱性,消耗的 NaOH 溶液体积要大于300mL,D对。
Al(OH)3 + 3H+(2)NH4Al(SO4)2是强酸弱碱盐,发生水解使得溶液显酸性,升高温度,水解程度增大,溶液酸性增强,pH减小,故符合的图示Ⅰ。(3)①100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,先发生的反应是Al3+ + 3OH—=Al(OH)3↓ ,根据NaOH溶液的浓度和体积知道NaOH溶液量还不能完全沉淀Al3+,所以发生的反应是Al3+ + 3OH—=Al(OH)3↓,a、b、c、d四点中a点的Al3+和NH4+浓度最大,水解程度最大,所以水的电离受到的促进程度最大。②b点时如果Al3+没有完全沉淀,Al3+、NH4+水解使得溶液显酸性,现显中性说明Al3+已经完全沉淀,A对;Al3+完全沉淀时NaOH溶液的体积最小要300mL,此时Na+的物质的量比 SO42-多,故c(Na+)>c(SO42-)>c(NH4+),B对;溶液显中性时Al(OH)3不会溶解,Al(OH)3溶于强碱性溶液,不溶于中性和弱碱性溶液,C错;消耗的 NaOH 溶液等于300mL时Al3+已经完全沉淀,溶液中还有NH4+发生水解,溶液显酸性,现溶液显碱性,消耗的 NaOH 溶液体积要大于300mL,D对。
考点:盐类水解、化学图像的分析、
本题难度:困难