时间:2017-02-07 15:53:04
1、填空题 (4分)有四种物质是:①0.5molCO2?? ②6gH2??③1.204×1024个HCl???? ④? 147gH2SO4,它们中物质的量最大的是___?,所含分子数最多 的是???__?,含有原子数最多的是___??,质量最大的是___???。(用序号填空)
的是???__?,含有原子数最多的是___??,质量最大的是___???。(用序号填空)
参考答案:② ,② ,④ ,④?? (共4分)
本题解析:略
本题难度:一般
2、选择题 下列排列顺序正确的是
A.常温下将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合,
c (Cl-)> c (Na+)> c(NH4+)> c (OH-)> c (H+)
B.常温下物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>②
C.0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A)
D.在相同条件下,将足量AgCl加入等体积的①0.01 mol·L-1 KCl②0.1 mol·L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
参考答案:B
本题解析:略
本题难度:简单
3、填空题 根据反应:Fe2O3+3CO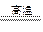 2Fe+3CO2,若有3 mol e-转移,则有_______mol 铁生成,有_______个CO分子参加反应。
2Fe+3CO2,若有3 mol e-转移,则有_______mol 铁生成,有_______个CO分子参加反应。
参考答案:1? 9.03×1023
本题解析:以氧化还原反应为载体,考查学生灵活运用所学知识的能力。
根据元素的价态变化不难看出,每生成1 mol Fe得3 mol e-,每有1 mol CO参加反应失2 mol e-,故有3 mol e-转移时,有1 mol Fe生成,消耗1.5 mol CO,N(CO)=n(CO)·Na="1.5" mo
本题难度:简单
4、填空题 (每空2分,共10分)在同温同压下,对于等质量的SO2和CO2两种气体,求其下列各项比值。
(1)摩尔质量比__ (2)密度比__ (3)物质的量比__ (4)体积比___ (5)分子数比__
参考答案:16:11 16:11&
本题解析:
试题分析:设质量分别为1g,则n(SO2)=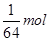 、n(CO2)=
、n(CO2)=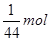 ;(1)摩尔质量的数值等于相对分子质量;所以摩尔质量比等于相对分子质量之比,为16:11;(2)根据阿伏伽德罗定律的推论,同温同压下气体密度比等于摩尔质量比,为16:11;(3)物质的量比为
;(1)摩尔质量的数值等于相对分子质量;所以摩尔质量比等于相对分子质量之比,为16:11;(2)根据阿伏伽德罗定律的推论,同温同压下气体密度比等于摩尔质量比,为16:11;(3)物质的量比为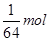 :
: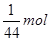 =11:16;(4) 根据阿伏伽德罗定律的推论,同温同压下,体积比等于物质的量比,为11:16;(5)分子数比等于物质的量比,为11:16。
=11:16;(4) 根据阿伏伽德罗定律的推论,同温同压下,体积比等于物质的量比,为11:16;(5)分子数比等于物质的量比,为11:16。
考点:本题考查阿伏伽德罗定律。
本题难度:一般
5、选择题 配制一定物质的量浓度溶液时,下列操作会使配得溶液物质的量浓度偏高的是
A.没有洗涤烧杯和玻璃棒
B.定容时凹液面最低点低于刻度线
C.容量瓶用蒸馏水洗涤干净后没有进行干燥就移入所配制溶液
D.转移过程中有少量溶液溅出
参考答案:B
本题解析:
试题分析:A.没有洗涤烧杯和玻璃棒,溶质减少,浓度偏低,错误;B.定容时凹液面最低点低于刻度线,体积偏小,浓度偏高,正确;C.容量瓶用蒸馏水洗涤干净后没有进行干燥就移入所配制溶液,无影响,错误; D.转移过程中有少量溶液溅出,浓度偏低,错误。
考点:配制一定物质的量浓度溶液误差分析。
本题难度:一般