时间:2017-02-07 15:36:28
1、简答题 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: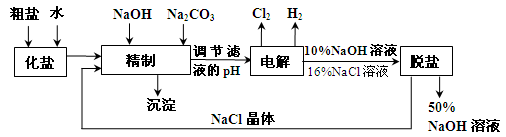
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为?????。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为????。
(3)精制过程要除去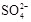 ,可选择下列溶液中的???(填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的???(填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
a.Ba(OH)2?????????? b.Ba(NO3)2????????? c.BaCl2
(4)在实际生产中也可以用BaCO3除去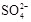 (已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:?????。
(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:?????。
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、???、(填操作名称)而制得50%的NaOH溶液。
参考答案:(1)H:H
(2)Mg2++2OH-=Mg(OH)2
本题解析:
试题分析:(1)在阴极上氢离子发生还原反应生成H2(2)加入氢氧化钠目的是除去镁离子;(3)除杂满足的原则是除去杂质还不能引入新的杂质,b选项中引入的硝酸根离子没法除去,a中引入的氢氧根离子可通过调节pH而除去,a和c中过量的钡离子都可以通过和碳酸根离子反应而除去,故选a、c;加入碳酸钠一定放在加钡离子之后,用碳酸根离子把过量的钡离子除去;(4)难溶的碳酸钡可以转化成更难溶的硫酸钡;(5)根据信息利用两者溶解性的差异可得分离两者的办法是冷却结晶,氯化钠的溶解度受温度的影响较小,过滤出氢氧化钠晶体,
本题难度:一般
2、填空题 ??? [化学一选修2:化学与技术](15分)已知:
①工业上用硫酸与 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图: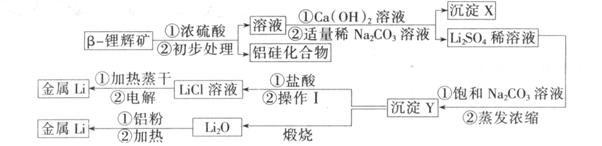
请回答:
(1)沉淀Y的主要成分的化学式是____________。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其使用的原因____________
(3 )操作1涉及的实验方法是__________________。
(4 )写出用铝粉还原法制取金属锂的化学反应方程式。________________________
(5) LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是__________________
(6) 目前电池通常使用金属锂的优点是__________________
参考答案:(1) Li2CO3(2分)
(2) CaCO3的溶解
本题解析:本题以工业制锂为载体考查了沉淀溶解平衡,水解、原电池和电解等相关原理
(1)硫酸锂和碳酸钠饱和溶液反应,生成碳酸锂沉淀和硫酸钠,根据Y灼烧的产物是氧化锂可知, Y是碳酸锂。
(2)X是氢氧化镁和碳酸钙沉淀,由于CaCO3的溶解度小于Li2CO3,加稀Na2CO3溶液既能除去溶液中的Ca2+,又不生成Li2CO3沉淀;而后来加饱和Na2CO3溶液的目的是使Li +转化生成Li2CO3沉淀。
(3)从溶液中分离出固体的方法应是过滤,过滤后晶体必须洗涤。
(4)在加热的条件下,铝可以发生
本题难度:一般
3、选择题 绿色化学提倡化工生产应提高原子利用率。在下列制备环氧乙烷的反应中,原子利用率最高的是 [???? ]
A.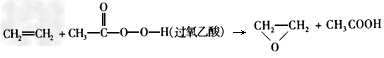
B.CH2=CH2+Cl2+Ca(OH)2→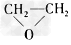 +CaCl2+H2O
+CaCl2+H2O
C.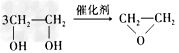 + HOCH2CH2-O-CH2CH2OH+2H2O
+ HOCH2CH2-O-CH2CH2OH+2H2O
D.2CH2=CH2?+?O2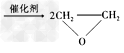 ??
??
参考答案:D
本题解析:
本题难度:简单
4、选择题 充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学的基本要求。①在有机实验中,用溴的四氯化碳溶液代替溴的水溶液;②用稀硝酸代替浓硝酸溶解、回收银镜试管中的银;③用水浴加热代替直接用酒精灯加热;④接触法制硫酸中采用“热交换器”,利用余热预热冷原料气和烧水;⑤工业合成氨中分离产物得到氢气和氮气再循环使用;⑥电解法冶炼钠和镁,选择电解氯化钠和氯化镁,不电解对应的金属氧化物。上述主要不是从绿色化学角度考虑的是(? )
A.①③
B.②④
C.⑤⑥
D.③④
参考答案:A
本题解析:①Br2、CCl4均有毒且易挥发,不符合绿色化学原理,②用稀HNO3代替浓HNO3溶解银,耗HNO3少且少放NOx气体,③水浴加热只提高受热面积,④⑤符合,⑥MgO为高熔点物质,电解它时会多耗能,⑥符合。
本题难度:一般
5、选择题 合成NH3所需的H2可由煤与H2O反应制得,其中有一步反应为CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。欲提高CO转化率可采用的方法可能有:①降低温度;②增大压强 ③使用催化剂 ④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )。
CO2(g)+H2(g) ΔH<0。欲提高CO转化率可采用的方法可能有:①降低温度;②增大压强 ③使用催化剂 ④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )。
A.①②③
B.④⑤
C.①⑤
D.⑤
参考答案:C
本题解析:该可逆反应的特点为:①正反应为放热反应;②反应前后气体体积不改变。结合勒夏特列原理可选出答案。
本题难度:一般