时间:2017-02-07 15:36:28
1、选择题 下列说法不符合生产实际的是( )
A.硫酸生产中,SO2催化氧化选择1~10 MPa、400~500 ℃条件下进行
B.尾气中含有少量SO2,可用石灰水吸收,然后再用硫酸处理
C.工业上,常采用以铁为主的催化剂,在400~500 ℃和10~30 MPa的条件下合成氨
D.造气中产生的CO,可在催化剂作用下,与水蒸气反应生成CO2和H2
参考答案:A
本题解析:
试题分析:硫酸生产中,SO2催化氧化选择条件为:常压、400~500 ℃。
点评:注意在工艺中对生产条件的选择,考虑产率和产量的双重因素。
本题难度:简单
2、填空题 A为无色晶体,B为淡黄色固体;X、C、E、G均为气体。其相关关系如图1-12所示: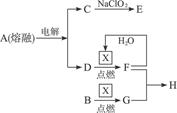
图1-12
(1)晶体A常用作城市道路融雪剂,由此可知C为__________,D为__________;
(2)E是新型饮用水消毒剂,其分子构型与G相同,由C生成E的化学方程式是____________________。E作为饮用水消毒剂的主要优点是:①____________________,②____________________。
(3)F与G生成H的化学方程式是____________________。
参考答案:(1)Cl2? Na?(2)2NaClO2+Cl2====2
本题解析:“晶体A常用作城市道路融雪剂”是本题的题眼——A是氯化钠;电解熔融的氯化钠可得钠和氯气;氯气与NaClO2得到的气体消毒剂应是二氧化氯;钠在氧气中点燃可得过氧化钠;硫在空气中点燃则得到二氧化硫;二氧化硫与过氧化钠反应生成的是硫酸钠。
本题难度:简单
3、填空题 (8分)【化学-化学与技术】
海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但常规蒸馏法法也存在较大缺陷,请说明常规蒸馏法淡化海水的最大缺陷。
__________________________________________________________
(2)离子交换法也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式?????????????????。
(3)目前从海水中提取溴的常用流程如下(苦卤,海水蒸发结晶分离出食盐的母液):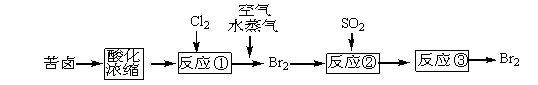
从反应③后的溶液中分离出单质溴的方法是???????????????????????。
(4)海水提镁过程中,与石灰窑和盐酸厂有着紧密的联系,试说明海水提镁与盐酸厂之间的必然联系。__________________________________________________________
参考答案: 本题解析:略 本题难度:简单 4、填空题 (12分)硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用,硫酸的产量是衡量一个国家化学工业水平的标志。工业上生产硫酸包括三步: 参考答案:(1)Fe2O3、SO2 (2分)???? 44mol (2 本题解析:略 本题难度:简单 5、选择题 酸雨的主要成分是H2SO4,以下是形成途径之一:NO2+SO2→NO+SO3①,2NO+O2→2NO2②,SO3+H2O→H2SO4③ 参考答案:A 本题解析:分析:A.根据N2+O2 本题难度:简单
小题1:需要使用大量燃煤,因此能耗多、排污量大
(1)第一步,在沸腾炉中煅烧黄铁矿,反应如下:4FeS2+11O2 8SO2+2Fe2O3,该反应的氧化产物是?????,当生成8 mol SO2时转移电子的物质的量为????。
8SO2+2Fe2O3,该反应的氧化产物是?????,当生成8 mol SO2时转移电子的物质的量为????。
(2)第二步,在接触室中发生如下反应:2SO2+O2  ?2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1????α2(填“大于”、“等于”或“小于”)。
?2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1????α2(填“大于”、“等于”或“小于”)。
(3)第三步,在吸收塔中将SO3转化成硫酸。硫酸是化学实验中的常用试剂:
①浓硫酸可以与多种物质发生化学反应,试写出浓硫酸与铜发生反应的化学方程式??????????????????????????????????。
②有Na、Mg、Al、Cu四种金属,若两两混合后取混合物14 g与足量稀硫酸反应,产生标准状况下H25.6 L,则此混和物的组合方式最多有??????种。
以下叙述错误的是?
A.NO2由反应N2+O2NO2生成
B.总反应可表示为2SO2+O2+2H2O2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O→4HNO3
D.还可能发生的反应有4NO+3O2+2H2O→4HNO3
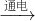 2NO;
2NO;
B.根据①×2+②+③×2;
C.根据3NO2+H2O═2HNO3+NO④以及④×2+②;
D.根据3NO2+H2O═2HNO3+NO④以及④×2+②×3;
解答:A.N2+O2 2NO,不能生成NO2,故A错误;
2NO,不能生成NO2,故A错误;
B.①×2+②+③×2得:2SO2+O2+2H2O═2H2SO4,故B正确;
C.利用3NO2+H2O═2HNO3+NO④以及④×2+②得:4NO2+O2+2H2O═4HNO3,故C正确;
D.利用3NO2+H2O═2HNO3+NO④以及④×2+②×3得:4NO+3O2+2H2O→4HNO3,故D正确;
故选:A.
点评:本题主要考查了方程式的书写,难度不大,根据课本知识即可完成.