时间:2017-02-07 14:51:15
1、实验题 如图是某同学利用日常用品注射器设计简易实验装置。甲管中注入10 mL CH4,同温同压下乙管中注入50 mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间。 
(1)下列是某同学预测的实验现象:
①气体最终变为无色;②实验过程中,甲管活塞向内移动;③甲管内壁有油珠;④产生火花。
其中正确的是______________。
(2)甲管中发生的化学反应类型为______________。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是_______________。
A.水 B.氢氧化钠溶液 C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到______________,若再向其中滴入几滴石蕊试液,又观察到________________。
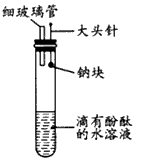
2、实验题 有人设计了如下图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物是什么。
3、实验题
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH==?________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为__________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)
①提出合理假设。
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:____________。
②设计实验方案,进行实验。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:3?mol/L?H2SO4、1?mol/L?NaOH、0.01?mol/L?KMnO4、淀粉-KI溶液、紫色石蕊试液。

4、选择题 某混合气体中可能含有Cl2、O2、SO2、NO、NO2、CO2中的两种或多种气体.现将此无色的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中错误的是( )
A.可能有CO2
B.可能有O2和CO2
C.肯定有SO2和NO
D.肯定没有Cl2、O2和NO2
5、实验题 已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: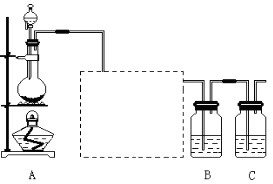
(1)装置A的分液漏斗中盛装的试剂是????????,烧瓶中加入的试剂是?????????。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用?????????????。
(3)装置B中盛放的试剂是????????(选填下列所给试剂的代码),实验现象为???????????????????????,反应的化学方程式为????????????????????????????。
A.Na2S溶液??? B.Na2SO3溶液??? C.Na2SO4溶液?
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)?????????????????。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为?????????????????????????????????????????????????。