时间:2017-02-07 14:49:56
1、选择题 在密闭容器中,一定条件下进行反应:mA(气)+nB(气) pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡,
pC(气)+qD(气),若增大压强,或升高温度,重新达到平衡, 随时间化过程均如图所示,则对该反应叙述正确的是(?????)??????????????????????????????????????????????????????
随时间化过程均如图所示,则对该反应叙述正确的是(?????)??????????????????????????????????????????????????????
A.正反应是放热反应,m+n < p+q
B.逆反应是放热反应,m+n > p+q
C.正反应是放热反应,m+n > p+q
D.逆反应是放热反应,m+n < p+q
参考答案:A
本题解析:略
本题难度:简单
2、计算题 已知2SO2(g)+ O2(g) 2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
(1)写出该反应的热化学方程式。??
(2)该反应中SO2的转化率是多少?
(3)其他条件相同,若起始时改为充入2 mol SO3,,计算达平衡后SO3的质量分数为多少?
参考答案:(6分,每空2分)
(1)2SO2(g)+ O2(g)
本题解析:考查热化学方程式的书写,可逆反应的有关计算,一般采用三段式。
2SO2(g)+ O2(g) 2SO3(g)
2SO3(g)
起始量(mol)??? 2?????? 1???????? 0
转化量(mol)??? 2x????? x???????? 2x+
平衡量(mol)? 2-2x??? 1-x?????? 2x
所以有2x=1.2mol
解得x=0.6mol
(1)因此如果消耗1mol氧气放出的热量是117.6 kJ÷0.6=196 kJ/mol
所以反应的热化学方程式是2SO2(g)+ O2(g) 2SO3(g)???△H=-196 kJ/mol
2SO3(g)???△H=-196 kJ/mol
(2)反应中SO2的转化率是2x÷2=0.6,即60%
(3)若起始时改为充入2 mol SO3,则平衡是等效的,因此平衡后SO3的质量分数为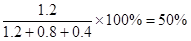
本题难度:一般
3、选择题 合成氨反应:3H2+N2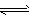 2NH3,其反应速率分别为v(H2),v(N2),v(NH3)(用mol·L-1·s-1表示),则正确的关系式是
2NH3,其反应速率分别为v(H2),v(N2),v(NH3)(用mol·L-1·s-1表示),则正确的关系式是
[???? ]
参考答案:C
本题解析:
本题难度:简单
4、选择题 一定温度下,有可逆反应,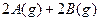

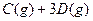 ,
,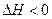 ,现将
,现将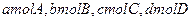 充入体积为V的某容器中,达平衡时各物质的浓度恰好相等,则升高一定温度后,反应达到新平衡时的化平衡常数可能为(?)
充入体积为V的某容器中,达平衡时各物质的浓度恰好相等,则升高一定温度后,反应达到新平衡时的化平衡常数可能为(?)
A.1
B.1.01
C.0.90
D.无法确定
参考答案:C
本题解析:略
本题难度:简单
5、实验题 (11分)某研究性学习小组为证明2Fe3+ + 2I-  ?2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
?2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是????????????????????????????。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是????????????????????????????????。
方案乙:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到???????????????????现象,即可证明该反应为可逆反应,请解释产生该现象的原因???????????????????????????????????????。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向?????方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为???????????????????????????。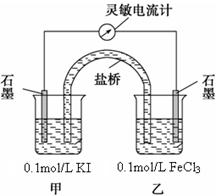
参考答案:(1)下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSC
本题解析:(1)根据实验数据可知碘化钾是过量的,若反应是可逆反应,则溶液中一定存在铁离子,同时也必须生成单质碘。所以可以通过检验铁离子和单质碘来证明。
(2)因为碘离子和亚铁离子在空气中也可以被氧气氧化生成单质碘和铁离子,所以方案不是很严密。
(3)可以依据外界条件对平衡的影响来验证。因为Fe3+与F-络合生成无色的FeF63-,促使2Fe3+ + 2I-  ?2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
?2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
(4)在原电池中负极是失去电子的,碘离子失去电子,所以电子是从甲池流向乙池,所以电流计的指针向左偏转。
本题难度:一般