时间:2017-02-02 07:13:57
1、填空题 有如下两个反应:
A 2HCl+Ba(OH)2===BaCl2+2H2O
B 2Fe3++Cu==2Fe2++Cu2+
(1) 根据两反应的本质,判断能否设计成原电池:A B (填“能”或“不能” )不能设计成原电池的原因是
(2) 根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是_______,正极材料是________,电解质溶液是 ___;
②写出负极的电极反应式 _;
③原电池工作时溶液中的Cl-从__________极向________极移动(填正或负)
④若导线上转移电子0.2mol,则负极质量变化是 ___ 减少 ___ ; 将此反应设计成原电池,若电解质溶液为H2SO4,
将此反应设计成原电池,若电解质溶液为H2SO4,
请写出正负极的电极反应;负极:_______________;正极:______________。
参考答案:(15分)(1)A不能,B能,A不是氧化还原反应(每空1分)
本题解析:
试题分析:(1)只有氧化还原反应才能设计生成原电池,A是中和反应,不能设计成原电池。B是氧化还原反应,可以设计成原电池。
(2)①根据B的方程式可知,铜失去电子,被氧化,则负极一定是铜,而正极材料可以是石墨等。铁离子得到电子,发生还原反应,则电解质溶液应该是氯化铁溶液。
②负极的电极反应式是Cu-2e===Cu2+。
③原电池工作时溶液中的Cl-从正极向负极移动。
④若导线上转移电子0.2mol,则负极质量减少0.1mol×64g/mol=6.4g。
(3)根据反应式可知,氢气失去电子,在负极通入。氧气得到电子,在正极通入。由于电解质溶液是硫酸,所以负极电极反应式是H2-2e===2H+,正极电极反应式是O2+4H++4e===2H2O。
考点:考查原电池的有关判断、电极反应式的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题在注重对基础性知识的巩固与训练的同时,侧重对学生能力的培养和方法的指导与训练。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力,提高学生的应试能力和学习效率。
本题难度:一般
2、选择题 把石墨棒和铁片用下列a、b两种方式放在盛有稀食盐水和酚酞试液混合溶液的玻璃器皿中,经过一段时间后,首先观察到溶液变红的区域是 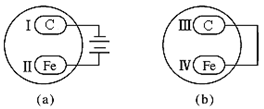
A.Ⅰ和Ⅲ附近
B.Ⅰ和Ⅳ附近
C.Ⅱ和Ⅲ附近
D.Ⅱ和Ⅳ附近
参考答案:A
本题解析:a为电解池,阳极铁失电子,阴极氢离子放电,剩下氢氧根,使酚酞变红;b为原电池,Fe负极,逐渐溶解,C为正极,同样氢离子放电(析氢腐蚀),故答案为A。
本题难度:一般
3、选择题 下列关于原电池的说法不正确的是 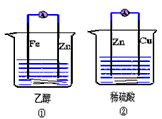 [???? ]
[???? ]
A.①②装置都能将化学能转化为电能
B.②中的硫酸根离子向负极移动
C.②中的电子由Zn流向Cu
D.②中电流的方向是由正极到负极
参考答案:A
本题解析:
本题难度:一般
4、选择题 某同学根据原电池原理设计了“苹果电池”(如图),下列有关说法中正确的是( )
A.苹果里有电解质溶液
B.铁片是此“苹果电池”的正极
C.将苹果换成番茄,小灯泡就不亮了
D.一段时间后取出Cu片,其质量减少
参考答案:A、两个电极插入苹果,灯泡发亮,说明形成了原电池反应,苹果中
本题解析:
本题难度:简单
5、选择题 下列叙述中正确的是 [???? ]
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
参考答案:D
本题解析:
本题难度:一般