时间:2017-02-02 07:10:42
1、填空题 (9分)现有浓度均为0.1 mol/L的下列溶液:①硫酸?②醋酸?③氢氧化钠?④氯化铵⑤硫酸铝?⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电 离出的H+浓度由大到小的顺序是??????????(填序号)。
离出的H+浓度由大到小的顺序是??????????(填序号)。
(2)已知T℃,Kw = 1×10-13,则T℃??????(填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = ??????????????????。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是???????????????????????????,产生该现象的原因是??????????????????????????????????????(用离子方程式解释原因)。
2、选择题 将1gH2和4gO2混合点燃,充分反应,放出71.45kJ热量,同样条件下1molH2在O2中完全燃烧放出的热量是
A.71.45kJ
B.142.9kJ
C.571.6kJ
D.285.8kJ
3、选择题 下列各组物质的燃烧热相等的是(???? )
A.碳和一氧化碳
B.1moL碳和2moL碳
C.1moL乙炔和2moL碳
D.淀粉和纤维素
4、选择题 实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH―→CH2=CH2↑+H2O。已知CH2=CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2=CH2(g)生成1 mol液态水的ΔH为( )
A.-44.2 kJ·mol-1
B.+44.2 kJ·mol-1
C.-2 777.8 kJ·mol-1
D.+2 777.8 kJ·mol-1
5、填空题 水的电离平衡曲线如下图所示。?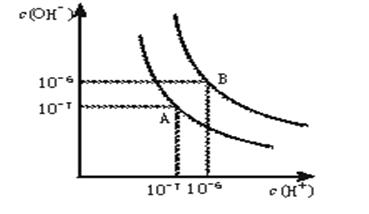 ?
?
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从????????????增加到????????????。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为??????????????????????。