时间:2017-02-02 06:58:38
1、填空题 (三选一)【选修三:物质结构与性质]
热敏电阻PTC元件的主要成份为钡钛矿,其晶体结构如图所示,该结构是具有代表性的最小重复单位。该晶体经X射线分析鉴定:重复单位为正方体,边长为403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有核心位置为O2-所占。 ??
回答下列问题: 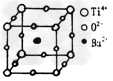
(1)钛的原子序数为22,其次外层有2个单电子,写出钛原子基态时核外电子排布式:___________________。
(2)写出晶体的化学式:_________________。
(3)若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体的位置是____________________________。
(4)在该物质晶体中,每个Ti4+周围与它最邻近且距离相等的Ti4+有__________个,它们在空间构成的形状是:______________。
(5)已知O2-半径为140pm,则Ti4+的半径为___________。
参考答案:(1)1s22s22p63s23p63d24s2
(
本题解析:
本题难度:一般
2、填空题 锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第____周期,第____族,____区。
(2)Zn形成金属晶体,其金属原子堆积属于下列_______模式。
A.简单立方 B.钾型 C.镁型 D.铜型
(3)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式_____;葡萄糖分子中碳原子的杂化方式为____。
(4)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于____(填“极性分子”或“非极性分子”);在[ Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在图1中表示
[Zn(NH3)4]2+中Zn2+与NH3之间的化学键。 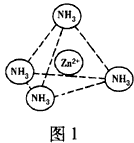
(5)图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
__________。该化合物晶体的熔点比干冰高得多,原因是_______________。 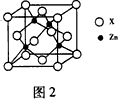
(6)与锌同周期,最外层有3个未成对电子的元素名称_______,该元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性_________(填“强”或“弱”)。
参考答案:(1)四;ⅡB;ds
(2)C
(3)1s2
本题解析:
本题难度:一般
3、选择题 晶胞是构成晶体的基本重复单元.在二氧化硅晶胞中有8个硅原子位???于立方晶胞的8个顶角,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内.根据图示二氧化硅晶胞结构,每个晶胞内所含“SiO2”基元数为( )
A.4个
B.6个
C.8个
D.18个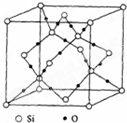
参考答案:C
本题解析:
本题难度:简单
4、选择题 目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子融进到Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列说法正确的是( )
A.它是由两种单质组成的混合物
B.它是一种碳酸盐
C.它是一种新型化合物
D.它是一种离子晶体
参考答案:C
本题解析:
本题难度:简单
5、选择题 纳米材料的表面微 粒占总微粒数的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图3所示),则这种纳米颗粒的表面微粒数与总微粒数的比值为?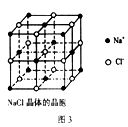 ???????????????
???????????????
A.7:8
B.13:14
C.25:26
D.26:27
参考答案:D
本题解析:
试题分析:该纳米颗粒的结构与氯化钠晶胞的结构不同,它是一个完整的颗粒结构,不为其他结构共用。8个顶点、12条棱的中点、6个面的中心共26个粒子,立方体的中心有1个粒子,所以表面粒子数与总粒子数的比值为26∶27,即答案选D。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养与基础知识的巩固与训练。该题的关键是理解氯化钠晶胞的结构,其次还要灵活运用,有利于培养学生的逻辑推理能力和空间的想象能力,也有助于培养学生的知识迁移能力。
本题难度:简单