时间:2017-02-02 06:58:38
1、填空题 (1)利用VSFPR模型推断下列分子或离子的空间构型。
PO43-____; CS2____; AlBr3(共价分子)____。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的两种粒子的球棍模型,写出相应的化学式 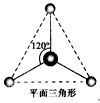 ___________;
___________;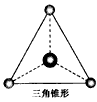 ___________
___________
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。平面三角形分子___________,三角锥形分子____________,正四面体形分子_____________。
2、选择题 下列化合物中,既有离子键,又有共价键的是
A.CaO
B.SiO2
C.H2O
D.Na2O2
3、选择题 2008年北京奥运会主体育场的外形好似“鸟巢”。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是 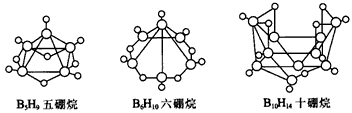 [???? ]
[???? ]
A.这类巢式硼烷的通式是BnHn+4
B.2B5H9+12O2 5B2O3+9H2O,1molB5H9完全燃烧转移25mol电子
5B2O3+9H2O,1molB5H9完全燃烧转移25mol电子
C.8个硼原子的巢式棚烷化学式应为B8H10
D.硼烷与水反应是非氧化还原反应
4、填空题 (1)根据VSEPR模型: ClO3-的价层电子对的几何分布呈________型,离子的空间结构呈________型;
(2)CH2Cl2的价层电子对的几何分布呈________型,分子的空间结构呈___________型;
(3)按要求写出由第三周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体形分子________,三角锥形分子_________??,V形分子___________;
(4)与SO42-互为等电子体的微粒(举两例)________、________;
(5)金属钠的晶胞如下图所示,实验测得钠的密度为d(g·cm-3)。已知钠的相对原子质量为M,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为?_____________; 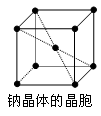
5、填空题 下图表示某种分子结构的电键图,大黑点表示从1~10号的原子实(原子实指原子除去最外层电子后的剩余部分),小黑点代表未用于成键的最外层电子,短线表示成键电子对(如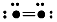 表示O2)现有
表示O2)现有 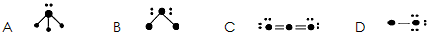
(1)据上图写出它们的化学式A___________B___________C____________D____________
(2)写出工业制取C的化学方程式____________________________该反应为____________反应(填“吸热”或“放热”)