448
?
请通过计算,推断出第②小组CuSO4分解的化学反应方程式:????????????????????????????。
若将①小组CuSO4分解时所得气体在一定条件下反应并达到平衡,恢复到反应前的温度和压强时,测得密度是反应前的 ,其平衡常数表达式为????????????????????????????????最终所得气体的平均相对分子质量为__________(保留一位小数) ,其平衡常数表达式为????????????????????????????????最终所得气体的平均相对分子质量为__________(保留一位小数)
参考答案:Ⅰ.SO3
Ⅱ.SO2、O2??
(1)⑥⑤③④
本题解析:
试题分析:I.根据猜想Ⅲ可知,猜想I是所得气体的成分可能只含SO2一种,猜想Ⅱ是所得气体的成分可能含有SO2、O2两种。
(1)根据所给的装置可判断,浓硫酸是用来干燥的,碱石灰是吸收SO2或三氧化硫的,最后通过排水法收集气体氧气,以测量氧气的体积,所以正确的顺序是⑥⑤③④⑧⑦②。
(2)SO2不溶于饱和NaHSO3溶液,而SO3溶于NaHSO3溶液。
(3)①中氧气是0.01mol,转移电子是0.04mol,所以一定生成0.02molSO2。其质量是1.28g,所以三氧化硫的质量是2.88g-1.28g=1.6g,物质的量是0.02mol,所以方程式为4CuSO4 4CuO+2SO2↑+2SO3↑+O2↑。分解时所得气体在一定条件下反应其平衡常数表达式为K= 4CuO+2SO2↑+2SO3↑+O2↑。分解时所得气体在一定条件下反应其平衡常数表达式为K= ,恢复到反应前的温度和压强时,测得密度是反应前的 ,恢复到反应前的温度和压强时,测得密度是反应前的 ,根据密度之比等于平均相对分子质量之比计算。 ,根据密度之比等于平均相对分子质量之比计算。
②中氧气是0.02mol,转移电子是0.08mol,所以一定生成0.04molSO2。其质量是2.56g,所以没有三氧化硫生成,则方程式为2CuSO4 2CuO+2SO2↑+O2↑。 2CuO+2SO2↑+O2↑。
本题难度:困难
5、实验题 实验室制备肉桂酸的化学方程式为:

副反应: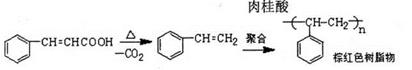
药品物理常数
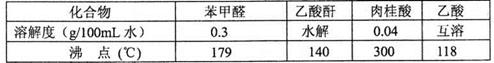
主要实验装置和步骤如下:
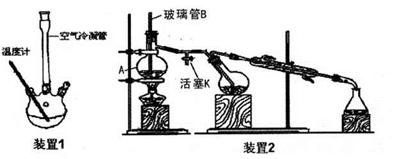
(I) 合成:
向装置1的三颈烧瓶中先后加入3g新熔融并研细的无水醋酸钠、3mL新蒸馏过的苯甲醛和 5.5mL乙酸酐,振荡使之混合均匀。在150~170℃加热回流40min,反应过程中体系的颜色会逐 渐加深,并伴有棕红色树脂物出现。
(II)分离与提纯:
①向反应液中加30mL沸水,加固体碳酸钠至反应混合物呈弱碱性。
②按装置2进行水蒸气蒸馏,在冷凝管中出现有机物和水的混合物,直到馏出液无油珠。
③剩余反应液体中加入少许活性炭,加热煮沸,趁热过滤,得无色透明液体。
④滤液用浓盐酸酸化、冷水浴冷却、结晶、抽滤、洗涤、重结晶,得肉桂酸无色晶体。 回答下列问题:
(1)合成过程中要求无水操作,理由是______。将含结晶水的醋酸钠加热制无水醋酸钠,观察到盐由固体→液体→固体→液体。第一次变成液体的原因是_____。
(2)合成过程的加热回流,要控制皮应呈微沸状态,如果剧烈沸腾,可能导致()
A.使肉桂酸蒸出影响产率
B.使乙酸酐蒸出影响产率
C.肉桂酸脱羧成苯乙烯,进而生成苯乙烯低聚物,甚至生成树脂状物
D.反应变缓慢
(3)仪器A的名称_____:玻璃管B的作用_____。
(4)分离和提纯操作中,步骤①加Na2CO3目的是_____。
(5)水蒸气蒸馏就是将水蒸气通入不溶或难溶于水但有一定挥发性的有机物中,使该有机物在 ,低于1000C的温度下,与水共沸而随着水蒸气一起蒸馏出来。步骤②的目的____,蒸馏结束后先____,再____,以防倒吸。
(6)步骤③加活性炭目的是____:若趁热过滤在抽滤装置中进行,下列操作错误的是()
A.布氏漏斗和滤纸要事先用沸水预热
B.各步操作的动作一定要快
C.为防止滤纸破损,混和液必须用玻璃棒引流至布氏漏斗
D.吸滤瓶内的溶液可直接从支管口倒出
参考答案:
(1)因乙酐遇水水解成乙酸,无水CH3COONa,遇
本题解析:
试题分析:
(1)由表格中信息可知醋酸酐能水解,所以合成过程中需控制无水操作;且无水醋酸钠遇水失去催化作用,影响反应进行。醋酸钠晶体加热失水,可观察到醋酸钠晶体变成液体。
(2)肉桂酸沸点高,此条件下不会蒸出,A错误;乙酸酐沸点低,此条件下能蒸出,B正确;由题给副反应可知C正确;温度越高反应速率越快,D错误。
(3)A为蒸馏烧瓶,B可防止压强过大,起安全管作用。
(4)肉桂酸在水中溶解度不大,步骤①加碳酸钠溶液使肉桂酸以盐的形式溶于水同时中和生成的副产物乙酸。
(5)步骤②除去未反应的苯甲醛。蒸馏结束后先打开活塞K,再熄灭酒精灯,防止发生倒吸。
(6)步骤③加活性炭目的是除去聚苯乙烯。抽滤时一般先转移溶液,后转移沉淀或晶体。转移溶液时,用玻璃棒引流。若转移不干净,可加入少量滤瓶中的滤液,一边搅动、一边倾倒,让滤液带出晶体,C错误;支管只用于连接橡皮管,不是溶液出口。将支管朝上,从瓶口倒出溶液,D错误。
本题难度:困难
|