时间:2017-02-02 05:41:09
1、选择题 在273 K和101 kPa的条件下,将2.00 g氦气,1.40 g氮气和1.60 g氧气混合,该混合气体的体积是(??? )
A.6.72 L
B.7.84 L
C.10.08 L
D.13.44 L
参考答案:
D
本题解析:
混合气体的物质的量:
n(He)+n(N2)+n(O2)=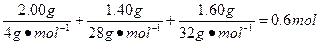
在标准状况(273 K,101 kPa)下的体积为:0.6 mol×22.4 L·mol-1="13.44" L。
本题难度:简单
2、选择题 用NA表示阿伏伽德罗常数,下列叙述正确的是
A.1mol碳正离子( CH5+ )所含的质子数为11NA
B.15g乙烷分子中所含非极性共价键数为3NA
C.标准状况下,22.4L苯完全燃烧所消耗的氧气分子数为7.5NA
D.1L 0.1mol/L乙酸溶液中H+数为0.1NA
参考答案:A
本题解析:
试题分析:A、碳元素和氢元素的质子数分别是6和1,所以1mol碳正离子( CH5+ )所含的质子数为11NA,A正确;B、乙烷分子中含有1个碳碳单键,属于非极性键。15g乙烷的物质的量=15g÷30g/mol=0.5mol,因此15g乙烷分子中所含非极性共价键数为0.5NA,B不正确;C、标准状况下,苯不是气体,不能适用于气体摩尔体积,因此标准状况下,22.4L苯完全燃烧所消耗的氧气分子数一定不是7.5NA, C不正确;D、乙酸是弱酸,存在电离平衡,所以1L 0.1mol/L乙酸溶液中H+数小于0
本题难度:一般
3、实验题 (12分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL 0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥容量瓶 ⑦托盘天平。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。配制时还欠缺的仪器是 。
(2)经计算,需浓H2SO4的体积为 mL(精确到0.1)。
(3)配制过程有以下操作:
A.移液
B.量取
C.洗涤
D.定容
E.溶解
F.摇匀
其正确的操作顺序应是 (填序号)。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)= 。
(6)某研究小组欲利用氯气和二氧化硫通入水溶液中来制备100mL含0.4molH+的溶液,反应原理:Cl2+SO2+2H2O= H2SO4+2HCl,若忽略制备过程中气体的损耗,请问需标准状况下的氯气 L。
参考答案:(1)(2分,每空1分)②④ ⑦ 胶头
本题解析:
试题分析:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、容量瓶,不需要的仪器是烧瓶、托盘天平和药匙,所以答案为②④ ⑦,配制时还缺少胶头滴管。(2)设需要98%H2SO4的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm3×98%=500mL×0.2mol?L-1×98g/mol,解得V=5.4ml。(3)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,所以操作顺序为B E A C A D F。(4)①洗涤量取浓H2SO4后的量筒,不需要将洗涤液转移到容量瓶中,否则实验结果偏高;②稀释后的H2SO4溶液应冷却至室温才能转移到容量瓶,否则冷却后容量瓶中溶液体积减少,浓度偏高;③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,这样会导致溶液的体积偏大,结果偏低④转移前,容量瓶中含有少量蒸馏水,对实验无影响⑤定容时,俯视标线,会使溶液的体积偏小,结果偏高。(5)取出溶液稀释了100/25=4倍,则浓度为原来的1/4,即0.2×2/4=0.1molL;(6)制备100mL含0.4molH+的溶液,由方程式可以知道每消耗1mol的氯气可以生成4mol的氢离子,故需要0.1mol氯气,即在标准状况下2.24L氯气。
考点:考查溶液的配制、误差分析。
本题难度:一般
4、计算题 (4分)将碳酸钠和碳酸氢钠的混合物27.4 g,加热到质量不再变化时剩余物质质量21.2 g。求混合物中Na2CO3和NaHCO3各多少g?
参考答案:m(NaHCO3)=16.8 g、m
本题解析:
试题分析:设NaHCO3的物质的量为x mol,则
2NaHCO3 Na2CO3+CO2?+H2O? ?m
Na2CO3+CO2?+H2O? ?m
2mol???????????????????????????????62g
xmol?????????????
本题难度:一般
5、简答题 (1)要配制浓度约为2mol/L?NaOH溶液100mL,下列操作正确的是(填代号)______.
A、称量8g?NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯
中,同时不断搅拌至固体溶解
B、称量8g?NaOH固体,放入100mL量筒中,边搅拌边加蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C、称量8g?NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加蒸馏水至刻度,盖好瓶塞,反复摇匀.
D、用100mL量筒量取40mL?5mol/L?NaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,再慢慢搅拌下慢慢倒入烧杯中
(2)要配制500mL?0.200mol/L的H2SO4溶液,需要的仪器有量筒、烧杯、______.需要98%的浓硫酸(密度1.84g/mL)______mL.下列操作会使所配的溶液浓度偏小的是(填代号)______.
A、用量筒量取一定体积的98%的浓硫酸,稀释后未经冷却即转入容量瓶内;
B、稀释硫酸所用的小烧杯未洗涤???
C、定容时仰视观察液面
D、定容时俯视观察液面???????????
E、用蒸馏水洗涤后的容量瓶未干燥
F、定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液溅出瓶外.
参考答案:(1)溶质的质量为m=nM=cvM=2mol/L×0.1L×
本题解析:
本题难度:一般