时间:2017-02-02 05:41:09
1、填空题 配制500mL?0.5mol?L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______.
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放的标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为______.假定最终称得小烧杯的质量为______(填“32.6g”或“32.61?g”).
(3)配制方法:设计五个操作步骤
①向盛有NaOH的烧杯中加入200?mL?蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1?cm~2?cm.
③将NaOH溶液沿玻璃棒注入500?mL容量瓶中
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作按正确顺序编出序号______.
(4)某学生实际配制NaOH溶液的浓度0.48mol?L-1,原因可能是______
A.?使用滤纸称量氢氧化钠固体???????B.?容量瓶中原来存有少量蒸馏水
C.?溶解后的烧杯未经多次洗涤???????D.定容时仰视刻度.
参考答案:(1)需氢氧化钠的质量为m=0.5L×0.5mol?L-1×
本题解析:
本题难度:一般
2、填空题 (11分)下图是中学化学的一个重要定量实验过程示意图,回答下列问题: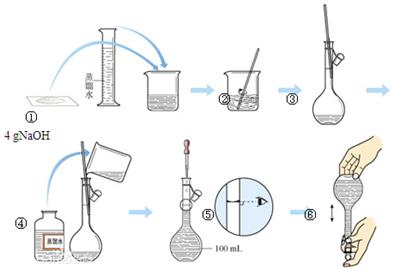
(1)该实验中的一处错误是 。
(2)该实验中,能较精确确定液体体积的两种玻璃仪器是 、 。
(3)操作过程中多次用到玻璃棒,请分别说明它们在实验中的作用:操作②中 、操作③中 。
(4)不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响(填“偏大”、“偏小”或“无影响”)。
a.在第②步操作中,有少量液体溅出烧杯外: 。
b.在第③步操作中,容量瓶内本来有少量水: 。
c.在第⑤步操作中,若俯视刻度线: 。
d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线: 。
(5)若操作全部正确,最后所得的溶液应存放在试剂瓶中,并贴上标签,请填写标签上的内容(如图) 。
参考答案:[第(5)小题2分,其余每空1分,共11分]
(1)N
本题解析:
试题分析:(1)该实验中的一处错误是图①中氢氧化钠易吸潮,应在称量瓶或小烧杯中称量,不能在纸上称量;(2)量筒和容量瓶都是量器,能准确量取溶液的体积。(3)玻璃棒,在实验操作②溶解中起到搅拌作用、在实验操作③转移中起到引流的作用;(4)a.在第②步操作中,有少量液体溅出烧杯外,溶质的物质的量减小,溶液浓度偏小;b.在第③步操作中,容量瓶内本来有少量水对溶液浓度没有影响;c.在第⑤步操作中,若俯视刻度线,溶液的体积偏小,浓度偏大;d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线,溶液体积增大,浓度偏低;(5)标签上应注明溶液的名称及溶液的浓度,4g氢氧化钠配成100ml溶液,浓度为1mol/L。
考点:一定物质的量浓度的溶液的配制
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是(????)
A.64g SO2含有氧原子数为NA
B.0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L H2O的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
参考答案:D
本题解析:
试题分析:A、64g SO2含有氧原子数为2NA,错误;B、溶液的体积不确定,因此不能确定其物质的量,错误;C、标况下,水是液体,错误;D、正确。
本题难度:一般
4、选择题 用等体积等物质的量浓度的BaCl2溶液可使相同体积的Fe2(SO4)3、FeSO4、K2SO4三种溶液中的SO42-完全转化为沉淀,则三种溶液的物质的量浓度之比为
A.1:3:3
B.1:1:1
C.3:1 :1
D.1:2:3
参考答案:A
本题解析:
本题难度:简单
5、选择题 在烧瓶中充满干燥标准状况下HCl与N2的混合气,已知其相对分子质量为34.8,进行喷泉实验后所得溶液的物质的量浓度为???????? ( )
A.0.022mol·L—1
B.0.045 mol·L—1
C.0.8 mol·L—1
D.0.1 mol·L—1
参考答案:B
本题解析:根据“十字交叉”法可得两者体积关系为:
设总体积为73L,则HCL所上体积为68L,进行喷泉实验后所得溶液的物质的量浓度为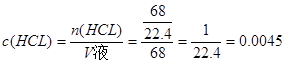 本题难度:一般
本题难度:一般