时间:2017-02-02 05:12:08
1、填空题 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
I、已知H2A在水中存在以下平衡:H2A ?H++HA-,HA-?
?H++HA-,HA-? H++A2-。
H++A2-。
⑴NaHA溶液_________?(选填“显酸性”、?“显碱性”、?“显中性”或“无法确定”)。
⑵某温度下,若向0.1?mol/L的NaHA溶液中逐滴滴加0.1?mol/L?KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是__________。
a.c(H+)·c(OH-)=1×10
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)??????????????
d.c(Na+)+c(K+)=0.05?mol/L
⑶已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡: CaA(s) ?Ca2+(aq)+A2-(aq)??△H>0。
?Ca2+(aq)+A2-(aq)??△H>0。
①温度降低时,Ksp_________??(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)?___________。
II、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3?mol·L-1的Cr2O72-。为使废水能达标排放,作如下处理: 
⑷欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入_________?g?FeSO4·7H2O。
⑸若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为___________??。(已知:Ksp[Fe(OH)3]=4.0×10-38???Ksp[Cr(OH)3]=6.0×10-31)
参考答案:⑴无法确定????????????
⑵bc
⑶
本题解析:
本题难度:一般
2、选择题 在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1
AgNO3溶液时,最先和最后沉淀的物质是
(AgCl、 AgBr、 Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12) [???? ]
A.AgBr、AgCl
B.Ag2CrO4、AgCl
C.AgBr、Ag2CrO4
D.同时沉淀
参考答案:C
本题解析:
本题难度:一般
3、选择题 难溶物质在水中达到溶解平衡的溶度积常数与水的电离平衡常数相似。则关于BaSO4溶解平衡: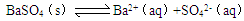 的下列说法正确的是(???)
的下列说法正确的是(???)
A.溶液的温度升高,BaSO4的溶度积常数不变
B.在Na2SO4溶液中,BaSO4的溶解度不变
C.在BaCl2溶液中,BaSO4的溶度积常数变小
D.精制NaCl时,在溶液中加入稍过量的BaCl2溶液是为了更好地除去SO42-等离子
参考答案:D
本题解析:溶度积常数受温度的影响,与离子浓度无关,则A、C错;在Na2SO4溶液中及在BaCl2溶液中溶解平衡均向逆向移动,则B错D正确。
本题难度:一般
4、填空题 (6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
参考答案:(1)S2-+H2O本题解析:
试题分析:(1) 硫化钠是强碱弱酸盐,水解显碱性,水解离子方程式为S2-+H2O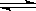 HS-+OH-(2)根据沉淀转化原理:溶解度小的可以转化为溶解度更小的沉淀,方程式为:Cu2++FeS= CuS+Fe2+(3)Ca(OH)2是微溶物,存在的溶解得平衡是:Ca(OH)2(S)
HS-+OH-(2)根据沉淀转化原理:溶解度小的可以转化为溶解度更小的沉淀,方程式为:Cu2++FeS= CuS+Fe2+(3)Ca(OH)2是微溶物,存在的溶解得平衡是:Ca(OH)2(S)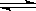 Ca2+ (aq)+2OH-(aq)
Ca2+ (aq)+2OH-(aq)
考点:水解,溶解平衡方程式的书写。
本题难度:一般
5、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案: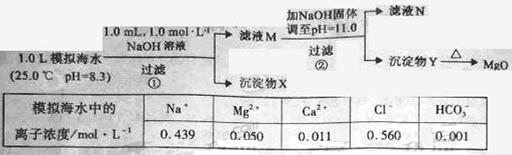
注:溶液中某种离子的浓度小于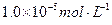 ,可认为该离子不存在;
,可认为该离子不存在;
实验过程中,假设溶液体积不变。
下列说法正确的是
A.沉淀物X为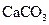
B.溶液M中存在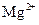 、不存在
、不存在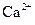
C.溶液N中存在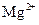 、
、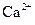
D.步骤②中若改为加入4.2g NaOH固体,沉淀物Y为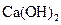 和
和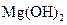 的混合物
的混合物
参考答案:A
本题解析:略
本题难度:一般