1
2
xy2
B.xy
C.xy2
D.4xy2
参考答案:难溶电解质AB2的电离方程式为:AB2(S)?A 2+(aq
本题解析:
本题难度:简单
3、选择题 向50 mL 0.018 mol/L AgNO3溶液中加入50 mL 0. 02 mol/L盐酸。已知AgCl(s)的溶度积常数Ksp=1×10-10,混合后溶液的体积变化忽略不计。下列说法不正确的是 [???? ]
A.混合后,溶液中肯定有沉淀生成
B.沉淀生成后溶液中Ag+的浓度为10-5 mol/L
C.沉淀生成后溶液的pH=2
D.混合后,升高温度,溶液中Ag+的浓度增大
参考答案:B
本题解析:
本题难度:一般
4、选择题 室温下,下列叙述正确的是
A.pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.对于0.1mol/LNa2SO3溶液:c(Na+)=2c(SO32-) + c(HSO3-) + 2c(H2SO3)
C.等浓度、等体枳的Na2CO3和NaHCO3混合: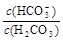 > >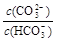
D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③
参考答案:AC
本题解析:
试题分析:A、根据电荷守恒可知:溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,所以pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(H+) + c(M+)=c(OH-) + c(A-),故A正确;B、根据物料守恒,对于0.1mol/LNa2SO3溶液:c(Na+)=2c(SO32-) + 2c(HSO3-) + 2c(H2SO3),故B错误;C、等浓度、等体枳的Na2CO3和NaHCO3混合: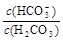 >1, >1,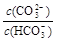 <1,所以 <1,所以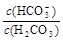 > >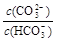 ,故C正确;D、②10mL0.2mol/LMgC12,Cl?浓度为0.4mol?L?1,③20mL0.3mol/L盐酸,Cl?浓度为0.3mol?L?1,溶解至饱和时c(Ag+):①>③>②,故D错误。 ,故C正确;D、②10mL0.2mol/LMgC12,Cl?浓度为0.4mol?L?1,③20mL0.3mol/L盐酸,Cl?浓度为0.3mol?L?1,溶解至饱和时c(Ag+):①>③>②,故D错误。
考点:本题考查离子浓度比较。
本题难度:困难
5、填空题 从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
物质
| CaCO3
| MgCO3
| Ca(OH)2
| Mg(OH)2
| 溶度积
| 2.8×10–9
| 6.8×10–6
| 5.5×10–6
| 1.8×10–11
?
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为??????????(填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是??????????????????????????????????;如果不能直接投入,应将贝壳作何处理,试写出化学方程式????????????????????????????????。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为??????????(填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他??????????(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是?????????????????????????????????????(用离子方程式表示)。
(3)已知海水中镁离子浓度为1.8×10–3mol·L–1,则要使镁离子产生沉淀,溶液的PH最低应为??????????。
参考答案:(1)不能(1分);???贝壳研磨成粉末仍是CaCO3,Ca
本题解析:
试题分析:(1)贝壳研磨成粉末仍是CaCO3,CaCO3的溶度积比MgCO3的溶度积小,所以将其直接投入海水中不能产生MgCO3;应将贝壳煅烧成CaO,CaO投入海水中生成的Ca(OH)2使海水中的Mg2+转化为Mg(OH)2沉淀。(2)NaOH电离出的OH–可与Mg2+反应生成Mg(OH)2沉淀。Mg(OH)2的溶度积MgCO3的溶度积,可以通过与烧碱反应把MgCO3沉淀转化为Mg(OH)2沉淀:MgCO3 + 2OH– = Mg(OH)2 + CO32–。(3)Ksp[Mg(OH)2]=c(M
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|