时间:2017-02-02 05:08:52
1、填空题 (三选一)【选修3--物质结构与性质】
下表为长式周期表的一部分,其中的编号代表对应的元素。 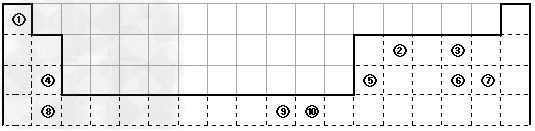
请回答下列问题:
(1)表中属于d区的元素是_________(填编号)。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为?______________(用对应的元素符号表示)。 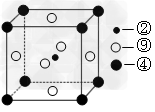
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是_________。
A.分子中含有分子间的氢键??????????????????????
B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键?????
D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为______________;该元素与元素①形成的18电子的X分子(分子量为32)的电子式为_________;该元素还可与元素①形成10电子的气体分子Y(分子量为17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为________________。
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。 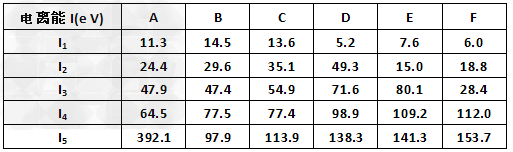
请回答:表中的金属元素是?___________??(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是?_______________。
参考答案:(1)⑨
(2)MgCNi3或CMgNi3?
(
本题解析:
本题难度:一般
2、填空题 (22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为??????;1mol O22+中含有的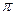 键数目为????。
键数目为????。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为??????。
(3)乙炔与氢氰酸反应可得丙烯腈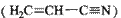 。丙烯腈分子中碳原子轨道杂化类型是??????;分子中处于同一直线上的原子数目最多为?????。
。丙烯腈分子中碳原子轨道杂化类型是??????;分子中处于同一直线上的原子数目最多为?????。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为??????。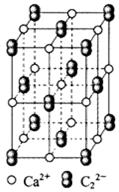
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是????????????;甲醛分子中碳原子的轨道杂化类型为????????????。
②甲醛分子的空间构型是????????????????;1mol甲醛分子中σ键的数目为??????????。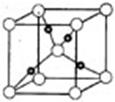
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为???????。
参考答案:本题解析:略
本题难度:简单
3、填空题 X、Y、Z、Q、W为按原予序数由小到大排列的五种短周期元素。已知:①X与Q处于同一主族,其原子价电子排布式都为n s2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
s2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … 请回答: (1)XY2分子的空间构型为???????????????。 (2)QX的晶体结构与金刚石的相似,微粒间存在的作用力是?????????????????。 (3)晶体ZW的熔点比晶体XW4明显高的原因是?????????????。 (4)XY2在高温高压下所形成的晶胞如图所示。该晶体的类型属于????(选填“分子”、“原子”、“离子”或“金属”)漏体,该晶体中X原子的杂化形式为___????。 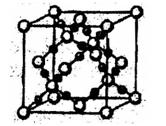 (5)氧化物MO的电子总数与QX的相等,则M为????。(填元素符号);MO是优良的耐高温材料,其晶体结构与ZW晶体结构相似,MO的熔点比CaO的高,其原因是????????。 参考答案: 本题难度:一般 4、选择题 根据晶体中的晶胞结构判断,下列晶体的化学式不正确的是 [???? ] 参考答案:A 本题解析: 本题难度:一般 5、选择题 北京大学和中国科学院的化学工作者合作,已成功研制出碱金 参考答案:C 本题解析:略 本题难度:一般 |