时间:2017-01-24 20:45:18
1、选择题 己知CuSO4溶液分别与 Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3主要:Cu2++CO32-+H2O→Cu(OH)2↓+CO2 ↑;次要:Cu2++CO32-→CuCO3 ↓
(2)CuSO4 + Na2S主要:Cu2++S2-→CuS↓;次要:Cu2++S2-+2H2O→Cu(OH)2↓+H2S ↑
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:
试题分析:物质发生反应时总是溶解度大的向溶解度小的转化,即向溶液中离子浓度小的方向进行。CuSO4与Na2CO3主要发生盐的水解反应形成Cu(OH)2沉淀,而CuSO4和Na2S主要发生复分解反应形成CuS沉淀,说明物质的溶解度:CuS<Cu(OH)2<CuCO3,故选项是A。
考点:考查物质的溶解度大小的比较的知识。
本题难度:一般
2、选择题 已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是(??)
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必不低于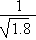 ×10-11 mol·L-1
×10-11 mol·L-1
参考答案:A
本题解析:根据溶度积常数可知,只要溶液中c(Ag+)·c(I-)>Ksp(AgI),就会产生碘化银沉淀,所以A是错误的。沉淀往往向生成更难溶的方向转化,所以选项BC都是正确的。要生成碘化银沉淀,则c(Ag+)·c(I-)>Ksp(AgI)。因为在氯化银溶液中,c(Ag+)=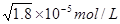 ,所以此时c(I-) >
,所以此时c(I-) >本题难度:一般
3、选择题 常温下,以下三种物质度积常数为:Ksp[Mg(OH)2]=1.2×10-11、Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=8.3×10-9。下列说法正确的是
A.温度升高,Ksp(AgCl)不变
B.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
C.常温下,将0.001 mol?L-1 AgNO3溶液滴入0.001 mol·L-1 KCl和 0.001 mol·L-1 K2CrO4溶液先产生Ag2CrO4沉淀
D.在Mg 2+为0.12 mol?L-1的溶液中要产生Mg(OH)2沉淀,应控制溶液的pH>9
参考答案:D
本题解析:
试题分析:溶度积常数只与温度有关系,升高温度,溶度积常数增大,A、B不正确;选项C中根据溶度积常数可知,生成氯化银和铬酸银时需要银离子的浓度分别是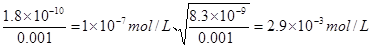 ,所以首先生成氯化银沉淀,C不正确;在Mg 2+为0.12 mol?L-1的溶液中要产生Mg(OH)2沉淀,则需要OH-的浓度是
,所以首先生成氯化银沉淀,C不正确;在Mg 2+为0.12 mol?L-1的溶液中要产生Mg(OH)2沉淀,则需要OH-的浓度是本题难度:一般
4、填空题 (15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
参考答案:(1)12 ; 90 ;
本题解析:
试题分析:(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。由图可知:温度越高,浸出率越高,时间越长,浸出率。但是考虑生产成本和效率,最佳的浸出时间为12小时;最佳的浸出温度为90 ℃;(2)用化合价升降法配平化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3= Na2Fe6(SO4)4(OH)12↓+ 5Na2SO4+ 6CO2↑;(3)KSP(CaF2)= c(Ca2+)×c2(OH-)=1.11×10-10; KSP(MgF2)= c(Mg2+) ×c2(OH-)=7.40×10-11,所以c(Ca2+)/c(Mg2+)= KSP(CaF2)÷KSP(MgF2)= 1.11×10-10÷7.40×10-11=1.50;(4)由于沉淀是从含有SO42-、NH4+、Na+、F-离子的溶液中过滤出来的,所以“沉淀”中含杂质离子主要有SO42-、NH4+、Na+、F-。把沉淀表面的杂质离子洗去、然后干燥就得到固体CoC2O4·2H2O。因此“操作X”名称为洗涤、干燥。(5)因为在充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以LiC6中Li的化合价为价;若放电时有1mole-转移,则有1mol的Li变为Li+结合为LiCoO2,所以正极质量增加7g。
考点:考查物质制备条件的选择、化学方程式的配平、在溶液中离子浓度的关系、混合物分离的操作、锂离子电池的工作原理的知识。
本题难度:困难
5、选择题 已知Ksp(AgCl)=1.8×10—10mol2?L—2,Ksp(AgI)=1.0×10—16mo2?L—2。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含浓度均为0.001mol?L—1的Cl—、I—的溶液中缓慢滴AgNO3稀溶液,先析出AgI
C.AgI比AgCl更难溶于水,所以AgCl可转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10—11mol?L—1
×10—11mol?L—1
参考答案:A
本题解析:
试题分析:A、Ksp(AgCl)>Ksp(AgI)>0,说明难溶于水的AgCl可以转化为更难溶的AgI,错误;B、由于Ksp(AgCl)>Ksp(AgI),因此优先析出AgI沉淀,正确;C、Ksp(AgCl)>Ksp(AgI),说明AgI比AgCl更难溶于水,则AgCl可以转化为AgI,正确;D、AgCl(s) 本题难度:一般
本题难度:一般