时间:2017-01-24 20:35:26
1、选择题 在一定条件下,Na2CO3溶液存在水解平衡: CO32-+H2O HCO3-+OH-,下列说法正确的是(???)
HCO3-+OH-,下列说法正确的是(???)
A.稀释溶液,水解平衡常数增大
B.加入NaOH固体,c(HCO3-)/c(CO32-) 减少
C.升高温度,平衡常数减小
D.通入CO2,pH增大
参考答案:B
本题解析: 本题难度:简单 2、选择题 某温下,在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( ) 参考答案:A、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根 本题解析: 本题难度:一般 3、填空题 (14 分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。 参考答案:(14 分) 本题解析: 4、简答题 (20分)硝酸铝是重要的化工原料。 参考答案:(20分) 本题解析: 本题难度:困难 5、计算题 在ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液是否有CuS沉淀生成?(必须写出判断理由)(已知:Ksp(ZnS)=1.6×10-24mol2/L2????????????Ksp(CuS)=1.3×10-36mol2/L2) 参考答案:[S2-]=[KSP(ZnS)]1/2=[1.6×10-24 本题解析:ZnS(s)
试题分析:稀释溶液,由于温度不变,水解平衡常数仍然不变,故A错误;加入NaOH固体,使得 CO32-+H2O HCO3-+OH-向左移动,所以c(HCO3-)/c(CO32-) 减少,故B正确,为本题的答案;水解过程是吸热过程,所以升高温度,平衡常数增大,故C错误;通入CO2,pH减小,所以D错误。
HCO3-+OH-向左移动,所以c(HCO3-)/c(CO32-) 减少,故B正确,为本题的答案;水解过程是吸热过程,所以升高温度,平衡常数增大,故C错误;通入CO2,pH减小,所以D错误。
A.[Ba2+]=[SO42-]=Ksp?
B.[Ba2+]?[SO42-]>Ksp[Ba2+]=[SO42-]
C.[Ba2+]?[SO42-]=Ksp[Ba2+]>[SO42-]
D.[Ba2+]?[SO42-]≠Ksp[Ba2+]<[SO42-]
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
????????????????????????????????????????????????????????????????????????。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。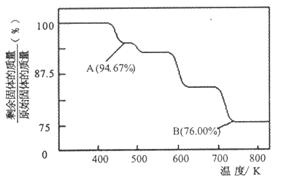
①A 点时剩余固体的成分是??????(填化学式)。B 点时剩余固体的成分是???????(填化学式)
②从开始加热到 750K时总反应方程式为????????????????????。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为?????????mol·L-1。
(1)4CrO3+3C2H5OH+6H2
试题分析:(1)根据题中所提供的反应物和生成物,方程式为4CrO3+3C2H5OH+6H2SO4 =2Cr2(SO4)3+3CH3COOH+9H2O。
(2)①CrO3的热稳定性较差,加热时逐步分解,根据图中所示的情况分析,A 点时剩余固体的成分是Cr3O8,B 点时剩余固体的成分是Cr2O3。
②加热到750K,CrO3分解成Cr2O3,个总方程式为4CrO3本题难度:一般
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化:  。
。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:
(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是 (填序号),转化Ⅲ开始的温度是 。
(1)B(2分)
(2)2Al+6H
试题分析:(1)硝酸铝中氮元素的化合价为+5,处于最高价,所以硝酸铝具有氧化性,在实验室中,硝酸铝必须与可燃物分开存放,故B项正确。
(2)Al作电极电解HNO3溶液制取Al(NO3)3,阳极上Al失电子生成Al3+,阴极上H+得电子生成H2,所以电解反应的离子方程式为:2Al+6H+ 2Al3++3H2↑。
2Al3++3H2↑。
(3)[Al(OH)]2+结合H2O中的羟基可转化为[Al(OH)2]+,所以离子方程式为:[Al(OH)]2++H2O [Al(OH)2]++H+。
[Al(OH)2]++H+。
(4)①根据元素守恒和电荷守恒,可知所缺离子为阳离子且含有N元素,为NH4+,根据观察法可配平该离子方程式。
②溶液中含有Al3+,经搅拌Ⅱ,Al3+的水解程度增大,所以pH下降。
③加入(CH2)6N4后生成NH4+,所以溶液中含有NH4NO3,根据pH=3.95可得c(OH?)=10-14÷10-3.95=10-10.05,则c(Al3+)=Ksp[Al(OH)3]÷c(OH?)3=1.3×10-33÷(10-10.05)3=1.3×10-2.85mol?L?1>1×10-5 mol·L-1,所以溶液还含有Al(NO3)3。
④转化II由γ-AlOOH转化为γ-Al2O3,失重率=18÷120×100%=12%,根据图像可知对应的失重阶段是i;转化III有γ-Al2O3转化为α-Al2O3,根据图像可知对应的失重阶段是iii,开始温度是600℃。
考点:本题考查物质的性质及应用、电解原理、方程式的配平及书写、化学流程及图像的分析。
 Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-),
Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-),
c(S2-)=[KSP(ZnS)]1/2=[1.6×10-24mol2/L2]1/2=1.61/2×10-12mol/L
CuS(s)本题难度:一般