时间:2017-01-24 19:14:39
1、选择题 下列化合物中,含有非极性键的离子化合物是[???? ]
①Ba(OH)2 ②H2SO4 ③Na2O2 ④CaCl2
A.③
B.①③④
C.③④
D.①②③④
2、填空题 有下列几种晶体,完成下列各小题。
A干冰;B氯化钠;C冰;D水晶;E氯化铵;F晶体氖;G铝;HC60;I金刚石
(1)属于分子晶体的是????????????????,属于离子晶体的是???????????????。
(2)晶体中有氢键的是?????????????????,受热熔化只需克服共价键的是________。
3、填空题 A、B、C、D均是1~20号元素,核电荷数依次增大.其中B、C、D的内层电子数为10,原子核外只有一个未成对电子.A原子核外有2个未成对电子.
(1)D离子的电子式是______;
(2)C原子的核外电子排布式为______;
(3)B离子的结构示意图是______;
(4)A元素的元素符号为______.
4、填空题 下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。?
(2)元素⑥形成的最高价含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnn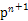 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是??????????????????????????????????????????????????。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是??????????????????????????????????????????????????。
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。?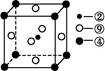
5、填空题 (每空2分?共16分)?20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;Ⅲ、分子中价层电子对之间的斥力主要顺序为:? i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;? ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;? iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;? iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
| n+m | 2 | ? |
| VSEPR理想模型 | ? | 正四面体 |
| 价层电子对之间的理想键角 | ? | 109°28′ (2)请用VSEPR模型解释CO2为直线型分子的原因????????????????????????。 (3) H2O分子的立体构型为:??????????,请你预测水分子中∠H-O-H的大小范围为??????????,原因是??????????????????????????????????。 (4) SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:?????????????。 |