时间:2017-01-24 18:46:22
1、推断题 有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88. 9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫_____,其晶体类型是________。B的氢化物的电子式为 _____________,属________(填“极性”或“非极性”)分子。
(2)A和B形成化合物的分子空间构型为_______,属________分子(填“极性”或“非极性”),其晶体类型是___________。
(3)C元素位于周期表中第____周期_____族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)_____________。
(4)C和D的化合物溶于水后滴入过量KOH,现象是__________,离子方程式_______________________。
参考答案:(1)金刚石;原子晶体;本题解析:
本题难度:一般
2、填空题 雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al________Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: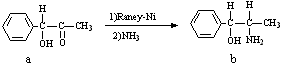 ,化合物b中进行sp3杂化的原子有:__________。
,化合物b中进行sp3杂化的原子有:__________。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:________________(选填序号:a.氯化钠 b.氯化铯 c.石英 d.金刚石)。 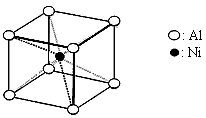
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。①Ni在基态时,核外电子排布式为:_________________。②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。 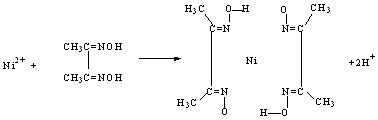
参考答案:(1)<
(2)C、N、O
(3)b
(
本题解析:
本题难度:一般
3、填空题 (13分)(1)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__????___(请用相应的编号填写)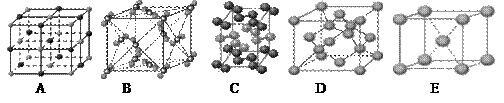
(2)一种离子晶体的晶胞如图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;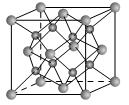
(3)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。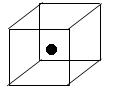
(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si | ||||||||||||
| 键能/kJ·mol—1 | 360 | 436 | 431 | 176 已知:工业上高纯硅可通过下列反应制取: SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 则该反应的反应热△H = ????????????? kJ/mol. 参考答案:(13分)(1)(2分)BC?(2)(各2分)4、8、CaF 本题解析:略 本题难度:一般 4、填空题 结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
|