________
________
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-??????????????(填“强”或“弱”)。
(4)实验反思
I. 根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是?????????????????。
Ⅱ. 在100 mLFeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为??????????。
参考答案:(1)2Fe2++Cl2=2Fe3++2Cl-;2Br-+C
本题解析:(1)因为单质溴和铁离子在溶液中均显黄色,氯气既能氧化亚铁离子生成铁离子,还能氧化溴离子生成单质溴。所以反应的离子方程式分别为2Fe2++Cl2=2Fe3++2Cl-、2Br-+Cl2=Br2+2Cl-。
(2)如果反应中生成铁离子,则加入KSCN溶液,溶液应该显红色。如果生成的是单质溴,则可以利用萃取进行验证。
(3)亚铁离子的还原性强于溴离子的,所以氯气首先氧化的是亚铁离子。
(4)如果氯水足量,则溴离子也被氧化生成单质溴。如果加入CCl4并充分振荡后静止,溶液应分上下两层,上层为黄色、下层为橙红色。如果FeBr2的物质的量是xmol,则根据得失电子守恒可知x×1+2x×1/2×1=0.1×2,解得x=0.1,所以浓度是1mol/L。
本题难度:一般
3、实验题 (15分)某实验小组同学对电化学原理进行了一系列探究活动。
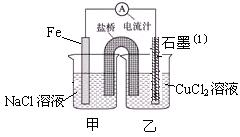
(1)右图为某实验小组依据氧化还原反应:(用离子方程式表示)?????????????????????设计的原电池装置,一段时间后,两电极质量相差12g,导线中通过?????mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为?????????????,这是由于NH4Cl溶液显???性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因???????????????,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式??????????????????,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式????????????。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是????????,电极反应为??????????;乙装置中石墨(1)为?????极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为???????,产物常用?????????检验,反应的离子方程式为????????。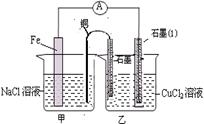
参考答案:
(1)Fe +Cu2+ ="==" Fe2+ + C
本题解析:略
本题难度:简单
4、实验题 已知1,2-二氯乙烷常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置(加热装置略去)。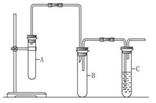
(1)如图所示,连接好仪器装置之后,首先需进行的操作是??????????????。
(2) 向装置A中大试管中加入1,2二氯乙烷和??????????????(写名称);并向装置C中试管里加入适量溴水。A中发生反应的化学方程式是 ????????????????????????????。
(3)与装置A中大试管相连接的长玻璃管除导气外的作用是 __________________,装置B的作用是 _________________。
(4)证明1,2 -二氯乙烷已发生消去反应的现象是_______________,还可通过什 -二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。 么实验加以验证:________________________________________。
参考答案:(1)检查装置的气密 本题解析:略 本题解析:略
本题难度:简单
5、实验题 (17分)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
(2)【实验】如下图所示:
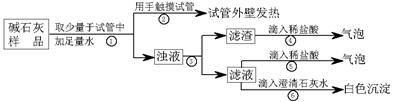
a、CaO与水反应的反应方程式为???????????????????????????????????。
b、操作③中玻璃棒的作用是?????????????????????????????????????????。
c、操作④发生化学反应的离子方程式为???????????????????????????????????;
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
????????(填:成立、不成立)
b.由操作⑤⑥的现象判断:滤液中含有???????????(写化学式);由此判断猜想Ⅰ
??????????(填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为?????????????????????。
参考答案:
(2)a. CaO+H2O==Ca(OH)2(3分)
本题解析:略
本题难度:简单
|