时间:2017-01-19 10:57:10
1、选择题 用石墨做电极,电解下列溶液,经过一段时间,溶液的pH下降的是 [???? ]
A.NaCl
B.NaOH
C.H2SO4
D.CuSO4
参考答案:CD
本题解析:
本题难度:一般
2、选择题 如图:甲为直流电源,乙为用含有酚酞的饱和食盐水浸透的滤纸,丙为电镀槽。断开K后,发现乙上c点附近显红色;闭合K,可实现铁上镀锌,电路中通过0.002NA个电子。以下判断正确的是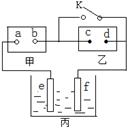
A.a为正极
B.d上发生还原反应
C.e为锌板
D.f的质量增加0.056 g
参考答案:AC
本题解析:
试题分析:A、断开K后,发现乙上c点附近显红色,这说明c点是阴极,氢离子放电产生氢氧根,则b点是负极,a是正极,A正确;B、d是阳极氯离子放电发生氧化反应,B错误;C、电镀时待镀金属作阴极,镀层金属作阳极。闭合K,可实现铁上镀锌,则e是锌板,f是铁板,C正确;D、电路中通过0.002NA个电子是铁板表面析出0.001mol锌,所以f的质量增加0.065 g,D错误,答案选AC。
考点:考查电化学原理的应用
本题难度:一般
3、选择题 应用电解法制备的物质主要有三种:一是铝的工业制备;二是电解饱和NaCl溶液制备烧碱;三是金属钠的制备.下列关于这三个工业生产的描述中正确的是( )
A.电解法制铝时一般是用熔融态的氧化铝进行电解,但也可用熔融态的A1C13
B.电解法生产铝时,每转移3mol电子的时候,就能生产出1mol的铝
C.在电解饱和NaCl溶液中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.电解饱和NaCl溶液和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
参考答案:A、电解法制取金属应电解熔融态的金属离子化合物,不能电解熔融
本题解析:
本题难度:一般
4、填空题 如何设计A、B、C、D分别符合下述要求: ?????????????????????
?????????????????????
(1)A中Fe棒不溶解但质量增加?????????????????????。
(2)B中Fe棒溶解,但Cu不在Fe上析出????????????????。
(3)C中Fe棒不溶于H2SO4??????????????????????????。
(4)D中ZnSO4浓度不变?????????????????????。
参考答案:(1)可插入Zn片用导线与Fe相连(或外接电源,Fe作阴极)
本题解析:根据原电池和电解池的电极反应来分析。
本题难度:简单
5、选择题 如图装置,U形管中装有50 mL 2 mol 的CuSO4溶液。通电一段时间后,下列说法正确的是
的CuSO4溶液。通电一段时间后,下列说法正确的是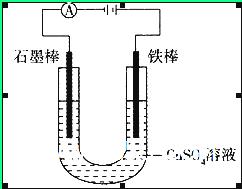
A.转移0.2 mol电子时,阳极减少质量大于阴极增加质量
B.转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体
C.电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解
D.若将石墨棒换成铜棒,可实现铁制品上镀铜
参考答案:B
本题解析:
试题分析:该电池中硫酸铜的总的物质的量为0.2mol ,可以电离出0.1mol 的铜离子。在阴阳两个电极上分别发生的反应为:阳极:Fe-2e-=Fe2+?阴极:Cu2++2e-=Cu 但是当溶液中的铜离子反应完全之后,就该溶液中由水电离出半的氢离子放电:2H++2e-=H2,因此A、转移0.2 mol电子时,阳极减少质量为5.6g,小于阴极增加质量6.4g,错误;B、转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体-氢气,正确;C、电解一段时间后,U形管中左端碳棒上会产生红褐色物质,
本题难度:一般