时间:2017-01-19 10:55:51
1、实验题 用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)准确称取一定量的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯????(B)洁净纸片??(C)直接放在托盘上
(2)准确量取10.00ml待测液于锥形瓶中,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用??????(填编号字母)作指示剂。 (A)甲基橙??(B)石蕊??(C)酚酞???
(3)若选用甲基橙作指示剂,滴定终点的判断依据是????????????????????????????
???????????????????????此时溶液显????????性。
(4)0.2000mol·L-1的盐酸应装在下图所示的??????????(填甲、乙)中,图Ⅰ所示为滴定前液面,图Ⅱ所示为滴定结束时液面,根据图示计算被测烧碱溶液的物质的量浓度是??????????????mol·L-1。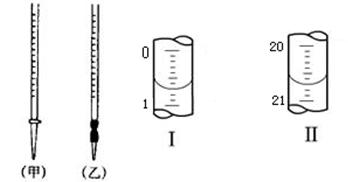
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果???????????。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果?????????。
参考答案:(1)(A)??(2)(B)
(3)当加入最后一滴标准
本题解析:
试题分析:(1)氢氧化钠是易潮解的物质,所以称量时必须要用烧杯或表面皿。
(2)石蕊的变色范围为5—8,变色范围较大,不适宜做指示剂。
(3)酸滴碱用甲基橙做指示剂,甲基橙的颜色由黄变为橙色,所以滴定终点的判断依据是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化,甲基橙的变色范围是3.1-4.4,此时溶液呈酸性。
(4)盐酸应该用酸式滴定管盛装,因此选择甲。如图可以看出所用酸的体积为20.00mL,根据c(H+)V(H+)= c(OH-)V(OH-),可以求出
本题难度:一般
2、选择题 下列说法正确的是(???? )
A.酸溶于水后能促进水的电离,碱溶于水后能抑制水的电离。
B.强酸溶于水后能抑制水的电离,弱酸溶于水后能促进水的电离。
C.任何条件下,只要c(H+)>c(OH-),溶液就一定显酸性。
D.任何条件下,只要pH>7,溶液就一定显碱性。
参考答案:C
本题解析:酸和碱都是抑制水的电离,AB都不正确;溶液的酸碱性只与溶液中氢离子和OH-浓度相对大小有关系,所以选项C正确,D不正确,答案选C。
本题难度:一般
3、选择题 下面有关各种形态的能量的相互转换途径叙述,错误的是(???)
A.家庭液化气灶将化学能转变为热能
B.灯泡将电能全部转变为热能
C.光合作用,将光能转变为化学能
D.太阳能电池将光能转变为电能
参考答案:B
本题解析:电灯将电能大多转变为光能,少部分转化为热能,B选项错。
本题难度:简单
4、填空题 (12分)已知下列热化学方程式:①H2(g) + O2(g)=H2O(l);ΔH="-285" kJ·mol-1
O2(g)=H2O(l);ΔH="-285" kJ·mol-1
②H2(g) +1/2 O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1
③C(s) +1/2 O2(g)=CO(g);ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g);ΔH="-393.5" kJ·mol-1
回答下列问题:
(1)H2的燃烧热ΔH为 ;C的燃烧热ΔH为 。
(2)燃烧1gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
参考答案: (12分,每空各3分)(1)ΔH="-285" kJ·mo
本题解析:考查燃烧热的判断、热化学方程式的书写及反应热的计算等
(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态水液态,所以氢气的燃烧热是)ΔH=-285 kJ·mol-1,碳的燃烧热ΔH=-393.5 kJ·mol-1。
(2)1g氢气是0.5mol,所以生成液态水时放出的热量是0.5mol×285 kJ·mol-1=142.5kJ。
(3)根据盖斯定律可知,(④-③)×2即得到2CO(g)+O2(g)=2CO2(g),所以反应热△H=(-393.5 kJ·mol-1+110.5 kJ·mol-1)×2=-566kJ·mol-1。
本题难度:一般
5、实验题 (12分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。??????
填空:(1)以上步骤有错误的是(填编号)?????????,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:????????????????????????????????????;
(4)如下图是某次滴定时的滴定管中的液面,其读数为?????????mL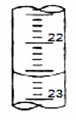
(5)根据下列数据:请计算待测盐酸溶液的浓度:???????????????????????mol·L-1
| 滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 参考答案:(1)① ,偏大(2)偏小?(3)当溶液恰好由无色变为粉红色 本题解析: 本题难度:一般 |