萃取
参考答案:C
本题解析:苯中混有苯酚加入溴水后苯酚与溴水生成沉淀,但是溴易溶于苯,会在苯中引入新的杂质溴,A错误;乙烷中混有乙烯通入酸性高锰酸钾溶液中后乙烯与酸性高锰酸钾反应生成二氧化碳,在乙烷中引入了新杂质二氧化碳,所以B错误;乙酸乙酯中混有乙酸,加入饱和碳酸钠溶液中后乙酸与碳酸钠反应,溶于溶液中,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,可以通过分液的方法分离,C正确;苯和溴苯相互溶解所以无法进行萃取实验,D错误;答案选C。
本题难度:简单
2、实验题 下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
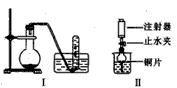
(1)铜与稀硝酸反应的离子方程式_____________________。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体_____(填“能”或“不能”),简述理由___________________________。
(3)若用Ⅱ实验装置进行实验可证明铜与稀硝酸反应生成的气体是 _______________。在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象_________________________。反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是_______________________________________。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是________________。
参考答案:(1)3Cu+8H++2NO3- = 3Cu2++2NO↑+
本题解析:
本题难度:一般
3、实验题 某化学课外小组所做实验的示意图如图所示。
图中“→”表示气体流向,M是一种纯净而干燥的气体,Y为另一种气体,E内有棕色气体产生。
实验所用的物质,只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。
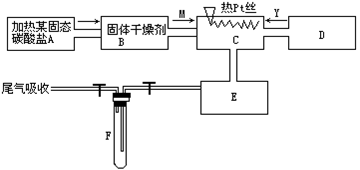
据此实验,完成下列填空:????????
(1)A中所用装置的主要仪器有____。
(2)B中所选的干燥剂是____,其作用是____。
(3)C中发生的主要反应的化学方程式是____。
(4)制取Y气体的D装置所用的主要仪器是____,制取Y气体的化学方程式是____。
(5)当F中充有一定量气体后,D停止送气,A停止加热,并立即关闭两个活塞,这时若将F汉入冰水中,可看到F中的现象是____,其原因是____。
参考答案:(1)大(硬质)试管、铁架台、酒精灯、单孔胶塞和玻璃导管。<
本题解析:本题考查通过实验条件、实现现象、判断物质和实验装置的能力。
“E内有棕色气体产生”是解答此题的突破点,纯净干燥的气体M和Y气在C中通过灼热铂金丝后,得棕色气体,是一个很明显的现象,中学学过的所有气体中,只有NO2是棕色气体,从本题所限定的反应物中,只能设法从(NH4)2CO3固体获取NO2,由此可以判断C中发生的主要化学反应是氨的铂催化氧化产生的NO继续被氧化。在E中得到棕色NO2气体,M和Y两种气体中有一种是NH3,另一种是O2,因为M是固态碳酸盐热分解产生的,而固态碳酸盐热分解不可能生成O2,因此可以得出:M是NH3,Y是O2的结论。
从题目给定的条件判断,由固态(NH4)2CO3热分解得到NH3,其分解产物中还有CO2和H2O(g),能吸收CO2和H2O(g)的物质;一般采用碱石灰,这样物质B可以确定,同样,由Na2O2与水反应制得O2,由这些反应又可以确定A和D中所需要的仪器装置。
本题难度:一般
4、选择题 如图所示的实验中,能达到实验目的的是

| 
| 
| 
| ①除去Cl2中的HCl杂质
| ②用铜和稀硝酸制取少量NO
| ③证明铁生锈时空气参与反应
| ④检验装置气密性
?
A.①②③④???????? B.③④???????? C.②③④????? D.①④
参考答案:B
本题解析:
试题分析:氯化氢极易溶于水,则除去Cl2中的HCl杂质可以选择饱和食盐水,但应该是长口进,短口出,①不正确;NO极易被氧化生成NO2,所以不能用排空气法收集,②不正确;实验③中铁生锈时如果空气参与反应,则U形瓶中但液面会发生变化,据此可以判断,③正确;根据检验装置气密性的方法可知,选项④正确,答案选B。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
5、实验题 请你协助化学兴趣小组的同学完成如下实验,并回答相关问题。实验目的:比较等体积0.5 mol·L-1硫酸、1 mol·L-1盐酸、1 mol·L-1醋酸分别与金属反应生成氢气的速率和体积。
(1)实验原理:(用离子方程式表示)________________。
(2)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由)。选择的金属是__________,不选其他两种金属的理由是__________________。
实验步骤:甲同学设计的实验装置:?

乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进。
(3)你认为乙同学改进的措施是__________________。
(4)按改进后的装置进行实验,观察现象并得出相关结论。实验现象及结论:________________________________________________________________________。
(5)反应开始时的速率:v(H2SO4)__________v(HCl)__________v(HAc)(用“=”“<”或“>”填空,下同),反应进行一段时间后的速率:v(H2SO4)<(HCl)__________v(HAc);
(6)最终得到的氢气体积:V(H2/H2SO4)__________V(H2/HCl)__________V(H2/HAc)。问题讨论:
(7)量筒的规格由__________________决定。
(8)对结论“(6)”“(7)”中盐酸和醋酸的异同,你的解释是__________________。
(9)根据现有知识,上述实验中硫酸和盐酸分别与金属反应的速率应始终都相等,但反应一段时间后有v(H2SO4)<v(HCl)。对此现象,你猜想可能的原因是__________________。大学无机化学对此问题将有科学的解释。
参考答案:(1)2H++Mg=H2↑+Mg2+,2CH3COOH+Mg
本题解析:
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|