时间:2017-01-19 01:47:21
1、填空题 已知:
①将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s) +O2(g)=CO2(g) △H=-393.5 kJ/mol
CO(g) +l/2O2(g)=CO2(g) △H= -283.0 kJ/mol
H2(g) +l/2O2(g)=H2O(g) △H= -242.0 kJ/mol
请回答:
(1)根据以上信息,写出C(s)与水蒸气反应的热化学方程式:________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的 热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图所示的循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。 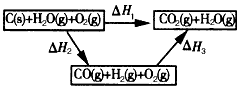
请分析:甲、乙两同学观点正确的是_____(填 “甲”或“乙”);判断的理由是_____________。将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点____________。
参考答案:(1)C(s) +H2O(g)=CO(g) +H2(g) △
本题解析:
本题难度:一般
2、选择题 已知:
(1)Zn(s)+?O2(g)===?ZnO(s),ΔH=?-348.3?kJ·mol-1, ?
(2)2Ag(s)+??O2(g)===?Ag2O(s),ΔH=?-31.0?kJ·mol-1,
则Zn(s)+?Ag2O(s)?===?ZnO(s)+?2Ag(s)的ΔH等于[???? ]
A.-317.3?kJ·mol-1????????
B.-379.3?kJ·mol-1????????
C.-332.8?kJ·mol-1???????
D.317.3?kJ·mol-1
参考答案:A
本题解析:
本题难度:简单
3、填空题 利用盖斯定律解答下列各小题
(1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:______.
(2)25℃、101kPa下:①2Na(s)+
| 1 2 O2(g)═Na2O(s)△H1=-414kJ?mol-1 ②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ?mol-1 写出该条件下由Na2O2和Na生成Na2O的热化学方程式:______ (3)已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1; 2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ?mol-1; 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H2=-2599kJ?mol-1; 写出由C(s,石墨)和H2(g)生成1mol?C2H2(g)的热化学方程式______. 参考答案:(1)已知①TiO2(s)+2Cl2(g)═TiCl4(l) 本题解析: 本题难度:一般 4、选择题 已知: 参考答案:A 本题解析: 本题难度:一般 5、选择题 已知25℃、101?kPa条件下: 参考答案:A 本题解析: 本题难度:一般 |