1、选择题 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g) △H=-393.51kJ·mol-1
C(金刚石)+O2(g)=CO2(g) △H=-395.41kJ·mol-1
据此判断,下列说法中正确的是 [???? ]
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
参考答案:A
本题解析:
本题难度:一般
2、填空题 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
(1)已知:CH4(g)+2O2?(g)=CO2?(g)+2H2O?(l)△H=-890.3kJ?mol-1?????①
H2(g)+1/2O2?(g)=H2O?(l)△H=-285.8kJ?mol-1?②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1?③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1?④
反应CH4(g)+H2O(g)
?高温?
.
?
??CO(g)+3H2(g),△H=______kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移______mole-,放出______kJ热量.
(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=______,降低温度,K值______(填“增大”、“减小”或“不变”).
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.(用相关符号和数据表示)
③判断该可逆反应达到平衡状态的标志是______.(填字母)
a.CH3OH的生成速率与CO的消耗速率相等???b.容器中气体的压强不变
c.容器中混合气体的密度保持不变???????????d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是______.(填字母)
a.向容器中再充入Ar????b.改变反应的催化剂
c.向容器中再充入CO??????????????????????d.升高温度.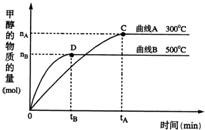
参考答案:(1)由CH4(g)+2O2?(g)=CO2?(g)+2H2
本题解析:
本题难度:一般
3、选择题 2008年9月我国“神七”发射升空,中国航天员实现首次太空行走.运载火箭的原料用肼(N2H4)作为发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol
下列判断正确的是( ? )A.所有物质与氧气发生的化学反应都是放热反应
B.N2H4的燃烧热为534kJ/mol
C.肼与NO2反应的热化学方程?2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1135.7kJ/mol
D..3.2g肼完全反应转移的电子数为0.6mol
参考答案:C
本题解析:
本题难度:简单
4、选择题 下面是四个化学反应的热化学方程式:
①C(s)+O2(g)=CO2(g) △H1
②2H2(g) +O2(g) =2H2O(l) △H2
③CH3COOH(l) +2O2(g)=2CO2(g)+2H2O(l) △H3
④2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H4
下列焓变之间的关系正确的是 [???? ]
A.2△H1=△H2 - △H3+△H4
B.△H2= 2△H1-△H3+△H4
C.△H3=2△H1 +△H2+△H4
D.△H4= 2△H1+△H2-△H3
参考答案:D
本题解析:
本题难度:一般
5、简答题 重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.
●高温煅烧还原法
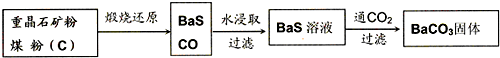
(1)煅烧还原的热化学方程式为:______
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+ 1
2
O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):______.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol?BaSO4,每次用1.00L?2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是______.
参考答案:(1)根据盖斯定律:a、Ba(s)+S(s)+2O2(g)=
本题解析:
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|