时间:2017-01-18 23:41:26
1、选择题 a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种。已知:①a、c均能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为?????????????????????????????????????????????????????
A.Fe Cu Al Ag Mg
B.Al Cu Mg Ag Fe
C.Mg Cu Al Ag Fe
D.Mg Ag Al Cu Fe
参考答案:C
本题解析:由(1)可判断出a、c是位于金属活动顺序中H前的金属,可能是Fe、Al、Mg中的两种。由(2)可判断出b的金属活动性大于d,即在金属活动性顺序中b在d前。由(3)可确定C为Al。由(4)可确定c、e为Al和Fe,既然c已确定为Al,则可确定e为Fe。回过头来再由(1)可知a为Mg。现在只剩下Cu、Ag两种金属尚未与字母挂联,再由(2)可知b的活动性大于d,则可确定b为Cu,d为Ag。综合以上所述,可确定a、b、c、d、e依次为 Mg、Cu、Al、Ag、Fe。故选项C符合题意。
本题难度:一般
2、填空题 胆矾(CuSO4·5H2O)是一种蓝色晶体,用它进行以下几个实验:①取少量胆矾晶体,用研钵研碎后,放入硬质玻璃管中,加热,可以看到固体颜色逐渐变成白色,同时试管口有水珠生成;②冷却后,取试管内白色粉末少许,用蒸馏水溶解后得到蓝色溶液,将此溶液分置于两支试管中;③向第一支试管中滴入NaOH溶液后,可观察到有蓝色沉淀生成;④将一枚洁净的铁钉放入第二支试管中,过一会,取出铁钉,观察到铁钉表面附着一层红色物质。用化学方程式表示上述变化,并指出所发生的反应的类型。
⑴加热胆矾晶体:???????????????????????????????????,(???????????);
⑵生成蓝色沉淀:???????????????????????????????????,(???????????);
⑶生成红色物质:???????????????????????????????????,(???????????)。
参考答案:CuSO4·5H2O本题解析:
试题分析:⑴CuSO4·5H2O)是一种蓝色晶体,CuSO4而是一种白色固体,所以加热胆矾晶体的化学反应方程式为CuSO4·5H2O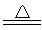 CuSO4+5H2O↑ ,该反应属于分解反应;⑵滴入NaOH溶液后,可观察到有蓝色沉淀生成,该蓝色沉淀为Cu(OH)2,其形成的化学方程式为CuSO4+2NaOH=Cu(
CuSO4+5H2O↑ ,该反应属于分解反应;⑵滴入NaOH溶液后,可观察到有蓝色沉淀生成,该蓝色沉淀为Cu(OH)2,其形成的化学方程式为CuSO4+2NaOH=Cu(
本题难度:一般
3、填空题 微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石.矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:???????????????????。
(2)从硫酸铜溶液中提取铜,简便而经济的方法是???????????????????????;相应的化学方程式为: ????????????????????????????????????。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
????????????????????????????????????????????????????????????。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe H2
H2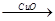 Cu ②CuO
Cu ②CuO CuSO4
CuSO4 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是???? ( )
A.①多
B.②多
C.相等
D.无法判断
(5)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为____________.电解粗铜制取精铜,电解时,阳极材料是__________,电解液中必须含有的阳离子是________.
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O?????? FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是????????????????????????。
参考答案:(1)催化作用 (2)向硫酸铜溶液加入废铁,将铜置换出来;F
本题解析:
试题分析:
(1)细菌把硫化铜氧化为硫酸铜的过程中,并未参与反应,起催化作用;
(2)利用废铁进行置换,既简便又经济。Fe+CuSO4=FeSO4+Cu;
(3)普通方法煅烧硫化铜,产生烟尘 和SO2气体污染环境。生物工程更有优点,它的优点是成本低、效益好,环境污染程度小。
(4)两方案的化学方程式为:②CuO+H2SO4═CuSO4+H2O;Fe+CuSO4═Cu+FeSO4①Fe+H2SO4 ═FeSO4+H2↑;H2+CuO 本题难度:一般
4、选择题 某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为血红色,说明原溶液中一定含有(???)
A.Fe3+
B.Cu2+
C.Fe2+
D.Zn2+
参考答案:C
本题解析:
试题分析:某溶液中加入KSCN溶液无明显现象,说明原溶液不含Fe3+,再加入氯水,溶液立即变为血红色,说明反应有Fe3+生成,则原溶液中一定含有Fe2+,选择C项。3+和Fe2+的鉴别
点评:熟悉Fe3+和Fe2+的分别鉴别的方法
本题难度:简单
5、填空题 铜、铜的氧化物及铜的氢氧化物都是常用的化学试剂。已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,Cu2O在空气中灼烧生成CuO。含有醛基的有机物与新制的氢氧化铜共热会出现Cu2O红色沉淀,某化学兴趣小组对此提出质疑,认为红色沉淀还可能是Cu2O和Cu的混合物,为了验证上述猜测,他们设计了如下三个方案:
| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣。 |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色。 |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称重,反复多次直到固体恒重称的固体质量为b g,比较a和b的关系。 (1)如果红色沉淀是Cu2O和Cu的混合物,按上述方案乙进行实验,写出可能发生反应的化学方程式??????????????????????????????????????; (2)上述三个方案中,你认为最合理的是??????,实施该实验方案能说明红色沉淀仅是Cu2O的依据是??????????????????????????????????????????????; (3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测。进行该实验时,称量装有红色样品的双通管并连接各仪器之后,点燃酒精灯前,应进行的实验操作是????????????????????????????????????????????。 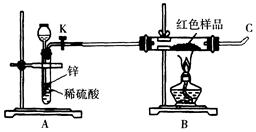 参考答案:(1)3Cu2O+14HNO3==6Cu(NO3)2+2NO 本题解析: 本题难度:一般 |