电解
R-R+H2+CO2+2KOH(R-代表烃基),下列说法正确的是( )
A.含碳元素的产物均在阳极区生成
B.含碳元素的产物均为阴极区生成
C.含氢元素的产物均在阳极区生成
D.含氢元素的产物均在阴极区生成
参考答案:电解时,阳极上失电子化合价升高发生氧化反应,阴极上得电子化合
本题解析:
本题难度:一般
2、填空题 MnO2、KMnO4等是中学化学中的常用试剂。请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂。若将MnO2加入酸化的H2O2溶液中,MnO2 溶解产生Mn2+,反应的离子方程式是 。
(2)用MnO2制KMnO4的工艺流程如图
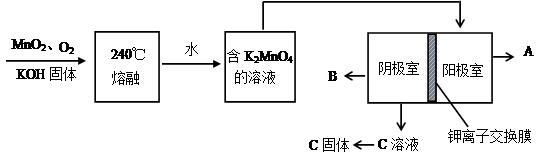
电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (写化学式,下同),可以循环使用的物质是 。
④钾离子交换膜的一种材料是聚丙烯酸钾(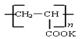 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。
⑤上述制得的KMnO4产品0.165 g,恰好与0.335 g经硫酸酸化的Na2C2O4反应完全,该KMnO4的
纯度是 (精确到0.1%)。
参考答案:(1)MnO2 + 2H+ + H2O2 = Mn2+ +
本题解析:
试题分析:(1)根据题意,结合电荷守恒、原子守恒、电子守恒,可得方程式为:MnO2 + 2H+ + H2O2 = Mn2+ + O2 ↑+ 2H2O。(2)①在240℃熔融时MnO2、O2、KOH发生氧化还原反应,根据质量守恒定律和电子守恒的知识可知发生该反应的化学方程式为:2MnO2 + O2 + 4KOH 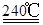 2K2MnO4 + 2H2O。由方程式可知在投料时必须满足n(KOH):n(MnO2)=2:1,为了使MnO2充分发生反应,KOH必须过量。因此二者的物质的量的比要大于2:1. ②由题意知道K2MnO4应该在阳极发生氧化反应,失去电子,被氧化为KMnO4。所以阳极的电极反应为MnO42- - e- = MnO4- 。③在阴极发生反应:2H2O+2e-=H2↑+2OH-.所以B物质是H2。根据电极反应式可以看出在此过程中可以循环的物质为KOH。④钾离子交换膜的一种材料是聚丙烯酸钾 。该物质为丙烯酸钾发生加聚反应得到的,其结构简式为 CH2=CHCOOK。⑤Na2C2O4与酸性KMnO4溶液发生反应的方程式为:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)="0.335" g÷134g/mol=0.0025mol;则根据反应方程式可知消耗的KMnO4的物质的量为0.0025mol×2/5=0.001mol.其质量为0.001mol×158g/mol=0.158g.所以该KMnO4的纯度是0.158g÷0.165 g×100%=95.8%.
2K2MnO4 + 2H2O。由方程式可知在投料时必须满足n(KOH):n(MnO2)=2:1,为了使MnO2充分发生反应,KOH必须过量。因此二者的物质的量的比要大于2:1. ②由题意知道K2MnO4应该在阳极发生氧化反应,失去电子,被氧化为KMnO4。所以阳极的电极反应为MnO42- - e- = MnO4- 。③在阴极发生反应:2H2O+2e-=H2↑+2OH-.所以B物质是H2。根据电极反应式可以看出在此过程中可以循环的物质为KOH。④钾离子交换膜的一种材料是聚丙烯酸钾 。该物质为丙烯酸钾发生加聚反应得到的,其结构简式为 CH2=CHCOOK。⑤Na2C2O4与酸性KMnO4溶液发生反应的方程式为:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)="0.335" g÷134g/mol=0.0025mol;则根据反应方程式可知消耗的KMnO4的物质的量为0.0025mol×2/5=0.001mol.其质量为0.001mol×158g/mol=0.158g.所以该KMnO4的纯度是0.158g÷0.165 g×100%=95.8%.
考点:考查化学方程式、离子方程式的书写、电解池的化学反应原理、聚合物与单体的相互转化、物质的转化率的计算的知识。
本题难度:困难
3、选择题 用石墨作电极,电解盛放在 形管中的饱和
形管中的饱和 溶液(滴有酚酞溶液),如下图。下列叙述正确的是
溶液(滴有酚酞溶液),如下图。下列叙述正确的是

A.阴极附近溶液先变红
B.电解时在阳极得到氯气,阴极得到金属钠
C.电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性
D.当阳极生成 气体时,整个电路中转移了
气体时,整个电路中转移了
参考答案:A
本题解析:惰性电极电解饱和食盐水,阳极氯离子失去电子,生成氯气。阴极氢离子得到电子,产生氢气。由于氢离子放电,破坏量阴极周围水的电离平衡,所以阴极周围溶液显碱性,A正确,B、C不正确。D不正确,0.1mol气体是氯气,转移电子是0.1mol×2=0.2mol电子,答案选A。
本题难度:简单
4、选择题 电化学降解法治理水中硝酸盐的污染原理如图所示。
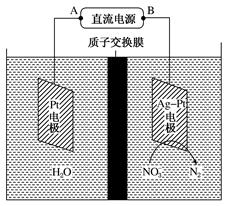
下列说法正确的是
A.B为电源正极
B.电解过程中H+ 向阳极移动
C.阴极反应式为2NO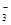 +6H2O+10e-=N2↑+12OH-
+6H2O+10e-=N2↑+12OH-
D.理论上电解过程中阴、阳两极产生的气体在同温同压下体积比为2︰5
参考答案:D
本题解析:
试题分析:根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,Pt电极为阳极。A、连接阳极Pt的电极A为电源正极,B为电源负极,错误;B、电解时电解质溶液中阳离子向阴极移动,错误;C、阴极上发生得电子反应,电解质通过H+移动导电,说明电解质溶液含有大量的H+,所以电极反应式为2NO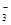 +12H++
+12H++
本题难度:一般
5、选择题 关于原电池和电解池的叙述正确的是[???? ]
A.原电池中失去电子的电极为阴极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
参考答案:B
本题解析:
本题难度:一般