时间:2017-01-16 18:02:05
1、填空题 (18分)已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 回答下列问题: (1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。 (2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。 (3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号) A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+] (4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L -1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”) 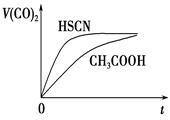 (5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。  (6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=________。 (7)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。 2、选择题 下列溶液中各微粒的浓度关系不正确的是( ) 3、选择题 当溶液中HS-+H2O 4、选择题 用水稀释0.5mol·L-1的醋酸溶液,其中随水量的增加而增大的是[???? ] 5、选择题 pH=1的两种一元酸HX和HY的溶液,分别取50mL,加入足量的镁粉,充分反应,收集的氢气的体积分别为V(HX)和V(HY),若V(HX)>V(HY),下列说法正确的是 [???? ] |