时间:2017-01-16 17:51:30
1、填空题 (1)电解饱和食盐水可以制得烧碱、氯气和氢气,该反应的化学方程式为:______.
(2)氯气用于生产半导体材料硅的流程如下:
(3)①石英砂的主要成分是______,在制备粗硅时,焦炭的作用是______.
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯.其提纯方法为______.
③由四氯化硅得到高纯硅的化学方程式是:______.
参考答案:(1)惰性电极电解饱和食盐水生成氯气、氢气和氢氧化钠,反应的
本题解析:
本题难度:一般
2、选择题 按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是(???)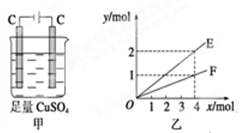
A.F表示反应生成Cu的物质的量
B.E表示反应实际消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
参考答案:B
本题解析:
试题分析:惰性电极电解硫酸铜溶液,生成物是铜、氧气和
硫酸,反应的化学方程式是2H2O+2CuSO4=2H2SO4+2Cu+O2↑。
由于生成1mol氧气转移4mol电子,而转移4mol电子生成2mol铜,所以F表示反应生成氧气的物质的量,E表示反应生成Cu的物质的量或生成硫酸的物质的量或消耗水的物质的量或消耗硫酸铜的物质的量,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生灵活运用
本题难度:简单
3、填空题 (共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。 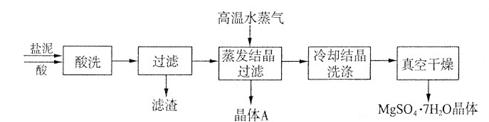 回答下列问题: ①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。 ②过滤所得滤渣的主要成分为____________________________。 ③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。 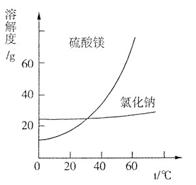 ④真空干燥MgSO4·7H2O晶体的原因是______________________。 (3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。 参考答案:(1)A、C 本题解析: 本题难度:一般 4、选择题 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是[???? ] 参考答案:CD 本题解析: 本题难度:一般 5、选择题 用惰性电极电解一定量的硫酸铜溶液,实验装置如图1所示。电解过程中的实验数据如图2所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标况)。则下列说法中正确的是 参考答案:B 本题解析: 本题难度:一般 |