时间:2017-01-16 16:37:33
1、填空题 现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加?????(填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答:?????????????????????????????????????。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是?????????。
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)="0.1" mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比=???????。
参考答案:(1)CO32- + H2O本题解析:
试题分析:(1) 纯碱碳酸钠是强碱弱酸盐。在溶液中存在的水解平衡主要是CO32- + H2O HCO3- + OH-,还有HCO3- + H2O
HCO3- + OH-,还有HCO3- + H2O 本题难度:一般
本题难度:一般
2、选择题 25℃时,将体积为Va、pH = a的某一元强酸溶液与体积为Vb、pH = b的某二元强碱溶液充分混合后,溶液的pH = 7,已知b = 6a,Va < Vb,下列有关b的说法正确的是
A.b可能等于12
B.b可能等于13
C.b一定小于12
D.b一定大于12
参考答案:C
本题解析:略
本题难度:一般
3、选择题 已知一种C(H+)=1×10—3mol·L-1的酸和一种C(OH—)= 1×10—3mol·L-1的碱溶液等体积混合后溶液显碱性,其原因可能是
A.浓的强酸和稀的强碱溶液反应
B.生成了一种强碱弱酸盐
C.浓的弱碱和稀的强酸溶液反应
D.等物质的量浓度的一元弱酸和一元强碱溶液反应
参考答案:C
本题解析:略
本题难度:一般
4、选择题 下列叙述不正确的是(????)
A.根据一次能源和二次能源的划分,氢气是二次能源
B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C.火电是将燃料中的化学能直接转化为电能的过程
D.在火电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化
参考答案:C
本题解析:燃煤发电是从煤在的化学能开始的一系列能量转换过程,转移为化学能 热能
热能 机械能
机械能本题难度:简单
5、选择题 在25℃、101 kPa下,1 g甲醇( CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是(???)
A.CH3OH(l)+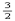 O2(g)===CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH="+1452" kJ/mol
参考答案:B
本题解析:甲醇的摩尔质量为32g/mol,所以1mol甲醇燃烧生成CO2和液态水时放的热量为32×22.68 kJ,所以,正确的热化学反应方程式为B;
A错,放热反应的反应热用“—”表示;同理D错;C错,热化学方程式中的化学计量数表示物质的物质的量;
本题难度:一般